时间:2019-06-28 21:09:25
1、选择题 只用食盐、食醋、纯碱三种家庭厨房中的常见物质,你无法完成的实验是( )
A.检验自来水中是否含氯离子
B.鉴别食盐和纯碱
C.检验鸡蛋壳能否溶于酸
D.除去热水瓶中的水垢
参考答案:A.一般利用硝酸银与氯离子反应生成白色沉淀来检验氯离子,家庭厨房中没有硝酸银,无法完成实验,故A选;
B.盐酸与食盐不反应,而纯碱与醋酸反应冒气泡,则能鉴别,故B不选;
C.鸡蛋壳的主要成分为碳酸钙,且醋酸的酸性大于碳酸的酸性,醋酸能溶解鸡蛋壳,则能完成实验,故C不选;
D.水垢的主要成分为碳酸钙,且醋酸的酸性大于碳酸的酸性,则可利用醋酸除去热水瓶中的水垢,能完成实验,故D不选;
故选A.
本题解析:
本题难度:简单
2、实验题 已知非金属单质硫是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: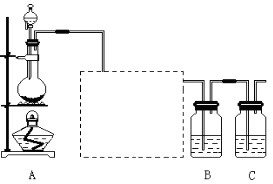
(1)装置A的分液漏斗中盛装的试剂是?,烧瓶中加入的试剂是?。
(2)画出虚线框内的实验装置图,并注明所加试剂,说明装置的作用?。
(3)装置B中盛放的试剂是?(选填下列所给试剂的代码),实验现象为?,反应的化学方程式为?。
A.Na2S溶液? B.Na2SO3溶液? C.Na2SO4溶液?
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)?。
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,该反应的离子方程式为?。
参考答案:(1)浓盐酸?; MnO2;
(2)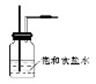 ?;除去Cl2中的HCl气体;
?;除去Cl2中的HCl气体;
(3)A ;有淡黄色沉淀生成 ; Na2S+Cl2 =2NaCl+ S↓ ;?
(4)HCl的稳定性比H2S的强,HClO4的酸性比H2SO4的强等
(5)Cl2 + 2OH— =Cl— + ClO—+ H2O
本题解析:(1)装置A用于Cl2的制取,把MnO2放在烧瓶中,把浓HCl放在分液漏斗中。(2)加热A装置,发生反应:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,由于HCl有挥发性,所以在洗气瓶中放入饱和NaCl溶液来除去Cl2中的杂质HCl。导气管的接法是长进短出。把经过除杂的氯气通入到饱和的Na2S溶液中,由于氧化性Cl2>S,所以会发生反应:Na2S+Cl2 =2NaCl+ S↓。由于S是淡黄色难溶于水的物质,因此会看到产生淡黄色沉淀。(4)证明元素的非金属性的强弱,除了活动性强的能把活动性弱的从化合物中置换出来外,还可以通过比较元素的氢化物的稳定性及相应的最高价氧化物对应的水化物的酸性强弱。即HCl的稳定性比H2S的强,HClO4的酸性比H2SO4的强等。(5)由于Cl2是有毒的气体,所以在排放到空气之前要用NaOH溶液对其进行尾气处理。该反应的离子方程式为Cl2 + 2OH— =Cl— + ClO—+ H2O。2的实验室制法、实验装置及试剂的选择、元素非金属性的比较、离子方程式的书写的知识。
MnCl2+Cl2↑+2H2O,由于HCl有挥发性,所以在洗气瓶中放入饱和NaCl溶液来除去Cl2中的杂质HCl。导气管的接法是长进短出。把经过除杂的氯气通入到饱和的Na2S溶液中,由于氧化性Cl2>S,所以会发生反应:Na2S+Cl2 =2NaCl+ S↓。由于S是淡黄色难溶于水的物质,因此会看到产生淡黄色沉淀。(4)证明元素的非金属性的强弱,除了活动性强的能把活动性弱的从化合物中置换出来外,还可以通过比较元素的氢化物的稳定性及相应的最高价氧化物对应的水化物的酸性强弱。即HCl的稳定性比H2S的强,HClO4的酸性比H2SO4的强等。(5)由于Cl2是有毒的气体,所以在排放到空气之前要用NaOH溶液对其进行尾气处理。该反应的离子方程式为Cl2 + 2OH— =Cl— + ClO—+ H2O。2的实验室制法、实验装置及试剂的选择、元素非金属性的比较、离子方程式的书写的知识。
本题难度:一般
3、选择题 鉴别下列各组物质的水溶液所选的试剂(括号内)中不正确的是( )
A.白酒、食醋(NaHCO3溶液)
B.葡萄糖、福尔马林[新制Cu(OH)2悬浊液]
C.食盐、纯碱(盐酸)
D.淀粉、鸡蛋清(碘水)
参考答案:A、白酒和碳酸氢钠互溶但不反应,无现象,食醋和碳酸氢钠反应生成二氧化碳气体,二者现象不同,可以鉴别,故A正确;
B、葡萄糖和甲醛都含有醛基,都能和新制氢氧化铜悬浊液反应生成砖红色沉淀,二者现象相同,不能鉴别,故B错误;
C、食盐和盐酸不反应,碳酸钠和盐酸反应生成二氧化碳气体,二者现象不同,可鉴别,故C正确;
D、淀粉遇碘变蓝色,这是碘的特征反应,鸡蛋清和碘不反应,二者现象不同,可鉴别,故D正确.
故选B.
本题解析:
本题难度:简单
4、实验题 某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应。
⑴ m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是
①常温下碳与浓硫酸不反应;②? ___________________?。
⑵写出加热时A中碳与浓硫酸发生反应的化学方程式? ______________________?。
⑶B中的现象是:? _______________________________________?;
C的作用是:? ___________________ _______________________?。
⑷待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为? _____________??(写表达式)。
(5)反应一段时间后,用滴管吸取A中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:?。
参考答案:⑴?常温下Fe遇浓硫酸发生钝化?⑵? C + 2H2SO4(浓) = CO2↑ + 2SO2↑ + 2H2O?
⑶?品红溶液褪色,或“颜色变浅” ?除尽反应产物中的SO2气体?
⑷?(11m-3b)/11m?
⑸既有Fe3+又有Fe2+?
取试样少许于试管中,先滴加少量的KSCN溶液,振荡后溶液显红色证明有Fe3+?;再取试样少许于另一支试管中,滴加少量的酸性KMnO4溶液,若浅红色褪去,证明溶液中含有Fe2+。
本题解析:常温下,铁遇浓硫酸发生钝化,炭与浓硫酸不反应;加热时,铁与过量浓硫酸生成硫酸铁、二氧化硫和水、炭与浓硫酸生成二氧化碳、二氧化硫和水。二氧化硫使品红褪色,酸性高锰酸钾溶液除去二氧化硫,浓硫酸干燥二氧化碳,二氧化碳被碱石灰吸收,由C+2H2SO4(浓)CO2↑+2SO2↑+2H2O得n(C)=n(CO2)=b/44mol,所以炭的质量分数为3b/11m,铁的质量分数为(11m-3b)/11m。反应一段时间后,A中的金属阳离子可能有Fe2+或Fe3+或Fe2+和Fe3+,检验A中存在Fe3+可用KSCN溶液,检验A中存在Fe2+可用酸性高锰酸钾溶液,Fe2+能使酸性高锰酸钾溶液褪色。
点评:本题实验装置须改进,因E中的碱石灰能吸收空气中的二氧化碳和水蒸气,所以应在E后再连一个E 装置,减少误差。
本题难度:一般
5、实验题 某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是_______________。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
[提出假设]
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe3+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:
______________________。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)。 
[思考与交流]
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO3-都氧化了Ag。你是否同意丙同学的结论,并简述理由:__________________________。
参考答案:(1)ade
(2)Fe3++Ag= Fe2++Ag+
(3)将银镜在硝酸铜溶液中
(4)同意,4Fe3++6H2O+9Ag+3NO3-==4Fe(OH)3+9Ag++3NO↑
本题解析:
本题难度:困难