时间:2019-06-28 20:51:17
1、选择题 25℃时,等体积pH都为4的NH4Cl溶液和硫酸溶液,下列有关说法正确的是
[? ]
①两溶液中:c(H+)>c(OH-),且c(H+)·c(OH-)=1×10-14
②两溶液中由水电离出的c(H+)均为1×10-10 mol·L-1
③NH4Cl溶液中c (Cl-)>c (NH4+)>c (H+)>c (OH-)
④两溶液中分别投入足量的镁粉,充分反应后放出相同条件下的等体积的气体
A.①②③④
B.①③④
C.①③
D.②③
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.Na2CO3溶液加水稀释后,恢复至原温度,pH和KW均减小
B.25℃时,pH=7的氨水和硫酸铵的混和溶液中,c(NH4+)=2c(SO42-)
C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2CO3]<c[(NH4)2SO4]<c(NH4Cl)
参考答案:A、Na2CO3溶液水解显碱性,加水促进水解,则n(OH-)增大,但体积增大的快,则c(OH-)减小,pH减小,而温度不变,则KW不变,故A错误;
B、pH=7,则c(H+)=c(OH-),电荷守恒式为c(NH4+)+c(H+)=c(OH-)+2c(SO42-),则c(NH4+)=2c(SO42-),故B正确;
C、pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)都为10-5mol/L,则c(H+)相等,故C错误;
D、若为1mol/L的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液,(NH4)2SO4溶液中c(NH4+)略小于2mol/L,(NH4)2CO3溶液中水解程度大,但c(NH4+)大于1mol/L而小于2mol/L,
NH4Cl溶液中c(NH4+)略小于1mol/L,反之,c(NH4+)相等时,NH4Cl溶液的浓度最大,其次为(NH4)2CO3溶液,故为c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl),故D错误;
故选B.
本题解析:
本题难度:一般
3、填空题 今有常温下两种溶液:
①0.1 mol·L-1 NH3·H2O溶液 ②0.1 mol·L-1 NH4Cl溶液
(1)溶液①的pH__ 7(填“>”“<”或“=”);
(2)溶液②呈____性(填“酸”“碱”或“中”),升高温度可以____(填“促进”或“抑制”)NH4Cl的水解;
(3)关于两种溶液中c(NH4+)的大小叙述正确的是____(填序号)。
a.两种溶液中c(NH4+)都等于0.1 mol·L-1
b.两种溶液中c(NH4+)都小于0.1mol·L-1
c.NH4Cl溶液中c(NH4+)小于NH3·H2O溶液中c(NH4+)
参考答案:(1)>
(2)酸;促进
(3)b
本题解析:
本题难度:一般
4、选择题 在25mL 0.1mol?L-1?NaOH溶液中逐滴加入0.1mol?L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是在( )
A.A、B间任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+(OH-)
B.在B点,a>25,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+)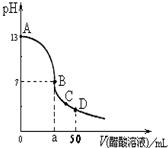
参考答案:A、A、B间任一点溶液呈电中性,溶液中阴阳离子所带电荷相等,即c(Na+)+c(H+)=c(CH3COO-)+(OH-),故A正确.
B、醋酸钠是强碱弱酸盐其水溶液呈碱性,要使溶液呈中性,酸的量应稍微大些,所以a>25;在B点溶液呈中性,即溶液中氢离子和氢氧根离子浓度相等,所以醋酸根离子和钠离子也相等,但中性溶液中水是微弱电离的,所以醋酸根离子浓度大于氢离子浓度,故B错误.
C、在C点,溶液呈酸性,溶液中氢离子浓度大于氢氧根离子浓度,根据溶液中电荷守恒知,溶液中醋酸根离子浓度大于钠离子浓度,故C正确.
D、在D点时,加入的醋酸的物质的量=0.1mol?L-1×0.05L=0.005mol,氢氧化钠的物质的量=0.1mol?L-1×0.025L=0.0025mol,根据物料守恒知,n(CH3COO-)+n(CH3COOH)=0.005mol,和钠离子的物质的量不相等,所以钠离子浓度与醋酸根离子浓度和醋酸浓度之和不相等,故错误.
故选AC.
本题解析:
本题难度:简单
5、选择题 下列关于电解质溶?液的正确判断是?
[? ]
A.在pH?=?12的溶液中,K+、Cl-、HCO3-、Na+可以大量共存?
B.在pH=?0的溶液中,Na+、NO3-、SO32-、K+可以大量共存
C.由0.1?mol/L一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH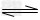 B++OH-?
B++OH-?
D.pH=2的一元酸和pH=12的一元强碱等体积混后溶液一定存在:c(?OH-)=?c(H+)
参考答案:C
本题解析:
本题难度:一般