时间:2019-06-28 20:51:17
1、选择题 下列说法不正确的是
[? ]
A.配制FeCl2溶液时,可将FeCl2晶体先溶于浓盐酸,再加水稀释和少量铁屑保存
B.输油管道,为防止其表面被腐蚀应涂上隔水材料并与外电源负极相连
C.pH值均为9的NaOH溶液和Na2CO3溶液,两溶液中水的电离程度相同
D.0.1mol/L?弱酸HA溶液与0.05mol/L?NaOH溶液等体积混合后所得溶液微粒浓度间有:
2c(H+)+c(HA)?=?c(A-)+2?c(OH-)
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列溶液中,粒子的物质的量浓度关系正确的是
[? ]
A.0.1?mol/L?Na2CO3溶液:c(Na+)=2c(H2CO3)+2c(HCO3-)+2c(CO32-)
B.0.1?mol/L?NH4Cl溶液:c(NH4+)=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-)
参考答案:AD
本题解析:
本题难度:一般
3、选择题 常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如图。下列说法正确的是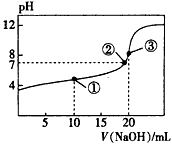
[? ]
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
参考答案:D
本题解析:
本题难度:一般
4、填空题 (1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。100℃时1?mol·L﹣1?的NaOH溶液中,由水电离出的c(H+)=_______mol/L, Kw(25℃)______Kw(100℃)(填“>”、“<”或“=”之一)。
(2)25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是__________(填“促进”“抑制”或“不影响”之一)。 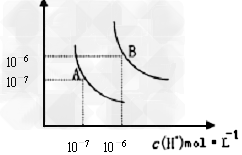
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的pH由大到小的顺序为_____________________。
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则 c(Na+)_______?c(CH3COO-)(填“>”、“<”或“=”之一)。
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为___________________?。
参考答案:(1)1×10-12;<
(2)促进
(3)①Na2CO3溶液的pH>NaCN溶液的pH>CH3COONa溶液的pH;②>;③NaCN+H2O+CO2=HCN+NaHCO3
本题解析:
本题难度:一般
5、选择题 下列水溶液显酸性的是( )
A.硫酸钠溶液
B.碳酸氢钠溶液
C.碳酸钠溶液
D.氯化铁溶液
参考答案:D
本题解析:
本题难度:一般