时间:2019-06-28 20:50:36
1、选择题 某氨水PH=x,某盐酸PH=y,已知x+y=14,且x>11。将上述氨水、盐酸等体积混合后,所得溶液中各种离子浓度由大到小的顺序是
[? ]
A.C(NH4+)>C(Cl-)>C(OH-)>C(H+)
B.C(Cl-)>C(NH4+)>C(H+)>C(OH-)
C.C(Cl-)=C(NH4+)>C(OH-)=C(H+)
D.C(Cl-)=C(NH4+)>C(OH-)>C(H+)
2、选择题 常温下,下列溶液中的微粒浓度关系正确的是( )
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+)
D.0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
3、选择题 下列混合溶液中,各离子浓度的大小顺序不正确的是
[? ]
A、10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合: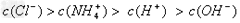
B、10mL1mol/LNH4Cl溶液与5mL2mol/LNaOH溶液混合: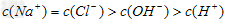
C、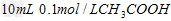 溶液与
溶液与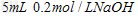 溶液混合:
溶液混合:
?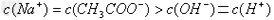
D、将pH=3的盐酸与pH=11的氨水等体积混合后:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
4、选择题 下列溶液中有关微粒的物质的量浓度关系正确的是
[? ]
A.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中
c(Na+)+c(H+)=c(Cl-)+c(CH3COO-)
B.在0.1 mol/L NaHSO3溶液中有
c(Na+)=c(HSO3-)+c(SO32-)
C.0.1 mol/LK2HPO4和0.2 mol/L KH2PO4的混合溶液中:
c(K+)+c(H+)=c(H2PO4-)+ 2c(HPO42-)+3c(PO43-)+c(OH-)
D.0.2 mol/L的NaHCO3溶液:
c(HCO3-)>c(CO32-) >0.1 mol/L>c(H2CO3)
5、选择题 下列说法正确的是( )
A.在KI溶液中加入氯化银,一段时间后沉淀变成黄色,说明同温度下K(AgI)<K(AgCl)
B.0.1mol?L-1的NaHCO3溶液:c(H+)+c(H2CO3)=2c(CO2-3)+c(OH-)
C.中和pH与体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比是1:1
D.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明酸性:HCO3-<Al(OH)3