时间:2019-06-28 20:42:43
1、选择题 将体积都为10mL、pH值均等于3的醋酸和盐酸,加水稀释至amL和bmL,测得稀释后溶液的pH值均为5。则稀释后溶液的体积大小关系?
[? ]
A.a=b=100mL
B.a=b=1000mL
C.a<b
D.a>b
参考答案:D
本题解析:
本题难度:一般
2、选择题 pH相同的CH3COOH和HCl溶液,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液的pH仍然相同,则m和n的关系是
A.m<n
B.m>n
C.m=n
D.不能确定
参考答案:B
本题解析:HCl是强酸,而CH3COOH是弱酸,存在电离平衡,稀释过程促进CH3COOH电离,向生成H+ 的方向移动,稀释前两溶液的pH相同,即c(H+)相同,若要稀释后两溶液的pH仍然相同,在CH3COOH溶液中要加入更多的水,才能保持CH3COOH和HCl溶液的pH仍然相同。选B。
本题难度:一般
3、填空题 (14分)已知:CH3COOH CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=
CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka= ;CH3COO-+H2O
;CH3COO-+H2O CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=
CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh= (式中各粒子浓度均为平衡时浓度)。
(式中各粒子浓度均为平衡时浓度)。
(1)对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解常数Kh以及水的离子积常数Kw的关系是_______________,由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度____________。如在25 ℃时碳酸的K1 草酸的K1(填“大于”、“等于”或“小于”),所以,在相同条件下,碳酸氢钠的溶液显 性,而草酸氢钠溶液显酸性。
(2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c mol·L-1的CH3COOH溶液中c(H+)=_________(不为0)。
(3)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;②______________;③用____________(填一种实验方法)测定溶液浓度c′。
参考答案:(14分)
(1)Ka·Kh=Kw越大 小于 碱
(2) mol·L-1
mol·L-1
(3)②溶液的pH ③酸碱中和滴定
本题解析:(1)已知CH3COOH CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=
CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=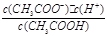 ;CH3COO-+H2O
;CH3COO-+H2O CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=
CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=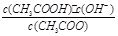 ,水的离子积常数Kw=c(H+)·c(OH-),所以对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解常数Kh以及水的离子积常数Kw的关系是Ka·Kh=Kw,根据三者之间的关系式可知,弱电解质的电离程度越小,其对应的离子水解程度越大,因为碳酸的酸性小于草酸的酸性,所以在25 ℃时碳酸的K1小于草酸的K1,在碳酸氢钠溶液中,HCO3- 的水解程度大于其电离程度,碳酸氢钠的溶液显碱性。
,水的离子积常数Kw=c(H+)·c(OH-),所以对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解常数Kh以及水的离子积常数Kw的关系是Ka·Kh=Kw,根据三者之间的关系式可知,弱电解质的电离程度越小,其对应的离子水解程度越大,因为碳酸的酸性小于草酸的酸性,所以在25 ℃时碳酸的K1小于草酸的K1,在碳酸氢钠溶液中,HCO3- 的水解程度大于其电离程度,碳酸氢钠的溶液显碱性。
(2)由于醋酸电离出的醋酸根离子与氢离子浓度近似相等,平衡时醋酸又可以看成是醋酸溶液的浓度,又知KwW=c(H+)·c(OH-),所以(H+)=  mol·L-1
mol·L-1
(3)根据Ka=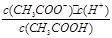 知,要测定电离平衡常数,则必须知道氢离子浓度和醋酸浓度,要想知道氢离子浓度必须测定溶液的pH值,要想知道醋酸浓度则必须利用酸碱中和滴定的方法测定,所以需测定的数据有:②溶液的pH ③用酸碱中和滴定测定溶液的浓度.
知,要测定电离平衡常数,则必须知道氢离子浓度和醋酸浓度,要想知道氢离子浓度必须测定溶液的pH值,要想知道醋酸浓度则必须利用酸碱中和滴定的方法测定,所以需测定的数据有:②溶液的pH ③用酸碱中和滴定测定溶液的浓度.
考点:考查电解质溶液中平衡常数的关系,溶液中离子浓度的计算,平衡常数的测定等知识。
本题难度:困难
4、填空题 (16分)(2012?山东)偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l)
参考答案:
本题解析:
本题难度:一般
5、填空题 已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度……今有HA、H2B、H3C三种一元、二元、三元弱酸,根据“较强酸 + 较弱酸盐 = 较强酸盐 + 较弱酸”的反应规律,它们之间能发生下列反应:
① HA + HC2-(少量) == A- + H2C-
② H2B(少量) + 2 A- == B2- + 2 HA
③ H2B(少量) + H2C- == HB- + H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C 三种酸中酸性最强的是_____________
(2)A-、B2-、C3-、HB-、H2C-、HC2- 六种离子中,最易结合H+的是______,最难结合H+的是______。
(3)下列反应一定能发生的是_________
A . H3C + 3 A- == 3HA + C3-
B . HB- + A- == HA + B2-
C . H3C + B2- == HB-+ H2C-
(4) 完成下列反应的离子方程式:
① H3C + OH-(过量):______________
② HA(过量) + C3- :_______________
参考答案:(1)H2B
(2)C3-;HB-
(3)B、C
(4)H3C +3OH- == C3- + 3H2O?
2HA + C3- == 2 A-+ H2C-
本题解析:
本题难度:一般