时间:2019-06-28 20:42:43
1、填空题 NaHCO3在水溶液中,HCO3-的电离程度小于HCO3-的水解程度。回答下列有关问题:
⑴H2CO3的电离方程式为?;
⑵NaHCO3溶液显碱性,原因是(用离子方程式表示)
?;
⑶在该溶液中,c(Na+)、c(H+)、c(HCO3-)、c(OH-)的大小关系为
?;
⑷根据电荷守恒原理,该溶液中离子浓度关系有:
c(Na+)+c(H+)=?;
⑸根据物料守恒原理,该溶液中离子浓度关系有:
c(Na+)=?。
参考答案:⑴H2CO3? H++HCO3-,? HCO3-? H++CO32-; ⑵HCO3-+H2O? H2CO3+OH-;?⑶c(Na+)>c(HCO3-)>c(OH-)>c(H+);
⑵HCO3-+H2O? H2CO3+OH-;?⑶c(Na+)>c(HCO3-)>c(OH-)>c(H+);
⑷c(HCO3-)+c(OH-)+2c(CO32-);?⑸c(HCO3-)+c(H2CO3)+c(CO32-)(各1分)
本题解析:略
本题难度:简单
2、填空题 已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
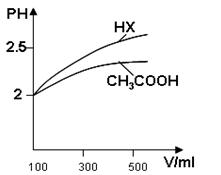
参考答案:(1)a d c b (2分)
(2)BD(2分)
(3)大于(2分) 稀释相同倍数,一元
酸HX的PH变化比CH3COOH大,故酸性强,电离平衡常数大。(2分)
(4)9.9×10-7(3分)? 18(3分)
本题解析:略
本题难度:一般
3、选择题 高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大.以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 | HClO4 | H2SO4 | HCl | HNO3 Ka 1.6×10-5 6.3×10-9 1.6×10-9 4.2×10-10 |
参考答案:A.在冰醋酸中高氯酸电离出的C(H+)=
本题解析:
本题难度:一般
4、选择题 在25℃时,将a mol/L的醋酸溶液与0.01mol/L氢氧化钠溶液等体积混合,充分反应后溶液呈中性。下列说法不正确的是?(?)
A.a一定大于0.01
B.反应后溶液中一定有c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C.反应后溶液中一定有c(CH3COO-)+c(CH3COOH)>c(Na+)
D.反应后溶液中一定有c(Na+)>c(CH3COO-)>c(H+)=c(OH)
参考答案:D
本题解析:溶液呈中性,c(H+)=c(OH-),溶液中阳离子带的正电荷总数等于阴离子带的负电荷总数,所以c(Na+)=c(CH3COO-)?故 D错
本题难度:简单
5、简答题 在80℃时,纯水的pH值小于7,为什么?
参考答案:已知室温时,纯水中的[H+]=[OH-]=10-7mol/L,又因水的电离(H2O?H++OH-)是吸热反应,故温度升高到80℃,电离度增大,致使[H+]=[OH-]>10-7mol/l,即pH<7.
答:因室温纯水的pH=7,升高到80℃,电离度增大,使[H+]=[OH-]>10-7mol/l,则pH<7.
本题解析:
本题难度:一般