时间:2019-06-28 20:42:02
1、填空题 电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制.某校实验小组精制粗盐水的实验过程如下:
请回答以下问题:
(1)操作a的名称是______,所用玻璃仪器有______;
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为______(填化学式)溶液;
(3)写出固体H所含物质的化学式______;
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;
溶解时:______.
过滤时:______.
蒸发时:______.
参考答案:(1)在食盐水中,实现溶液和泥沙难溶物的分离可以采用过滤的方法,故答案为:过滤;
(2)粗盐中含有Ca2+、Mg2+、Fe3+、SO42-杂质,加入过量试剂氢氧化钠后,可以将镁离子以及铁离子形成氢氧化镁和氢氧化铁沉淀,故答案为:NaOH;
(3)氯化钡可以让硫酸根离子形成硫酸钡沉淀,碳酸钠可以让钙离子以及过量的钡离子形成碳酸钙和碳酸钡沉淀,并且碳酸钠必须加在氯化钡之后,在第Ⅴ步中,加入试剂盐酸可以讲过量的氢氧化钠以及过量的碳酸钠除掉;故答案为:CaCO3和BaCO3;
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,软件工程是为了加快物质溶解,过滤是利用玻璃棒引流作用把需呀阿噢过滤的混合物进入过滤器,蒸发过程玻璃棒不断搅拌,避免局部受热引起液体飞溅,故答案为:加快溶解,引流,搅拌避免液体飞溅.
本题解析:
本题难度:一般
2、选择题 萃取碘水中的碘,可选取的萃取剂是( )
①四氯化碳;②汽油;③酒精.
A.只有①
B.①和②
C.①和③
D.①②③
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列说法正确的是
A.2mol的盐酸
B.0.1mol氢
C.0.3molHCl
D.4mol的氧元素
参考答案:C
本题解析:物质的量表示含有一定数目粒子的集合体,其单位是mol。在用表示微粒时,一般用化学式表示,而不用名称,所以选项C正确,其余都是错误的,答案选C。
本题难度:简单
4、填空题 利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下: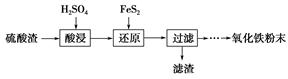
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率;②________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42—,该反应的离子方程式为________________________________________________________________________。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入稀盐酸、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应的化学方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62—
Sn2++4Cl-+2HgCl2=SnCl62—+Hg2Cl2↓
6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量________(填“偏高”、“偏低”或“不变”,下同);
②若不加HgCl2,则测定的Fe3+量________。
(4)①可选用________(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是________________________________________________________________________(用离子方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
参考答案:(1)抑制Fe3+的水解 (2)14Fe3++FeS2+8H2O=15Fe2++2SO42—+16H+ (3)①偏低 ②偏高
(4)①KSCN(或OH) 4Fe2++O2+4H+=4Fe3++2H2O ②a.向溶液中加入过量的酸性高锰酸钾溶液,搅拌 b.滴加NaOH溶液,调节溶液pH为3.2~3.8
本题解析:(1)Fe3+的水解方程式为Fe3++3H2O?Fe(OH)3+3H+,酸过量,抑制Fe3+的水解。(2)根据题给信息,写出反应物和生成物,因为在酸性环境下反应,则介质为H2O和H+,根据电子得失守恒和离子所带电荷守恒可以写出离子方程式。(3)①SnCl2不足,Fe3+没有完全反应,生成的Fe2+偏少,则消耗的K2Cr2O7标准溶液体积偏小,则测定的Fe3+量偏低;②若不加HgCl2,过量的Sn2+也能够被K2Cr2O7氧化,则消耗的K2Cr2O7标准溶液体积偏高,则测定的Fe3+量偏高。(4)①Fe3+与KSCN的络合反应或者Fe3+与OH的显色反应均可以用于鉴别。产生Fe3+的原因是Fe2+被空气中的氧气氧化。②“过滤”后的溶液中有Fe2+、Al3+、Mg2+以及少量Fe3+,首先将Fe2+完全氧化为Fe3+,然后控制pH,只使Fe(OH)3沉淀,从表格数据可以分析,控制pH为3.2~3.8。
本题难度:困难
5、选择题 除去下列物质中所含少量杂质的方法不正确的是(括号内的物质为杂质)( )
A.Cu粉(CuO):加稀硫酸、微热、过滤
B.乙醇(沸点为78℃)(NaCl):蒸馏
C.淀粉溶液(KI):渗析
D.KNO3溶液(I2):加酒精,分液
参考答案:A.CuO与硫酸反应,Cu和稀硫酸不反应,可加稀硫酸除去氧化铜,然后过滤可分离出铜,故A正确;
B.乙醇易挥发,用蒸馏的方法可分离出乙醇和NaCl,故B正确;
C.淀粉属于胶体,不能透过半透膜,可用渗析的方法分离,故C正确;
D.酒精和水互溶,不能作为萃取剂,应用苯或四氯化碳分离,故D错误.
故选D.
本题解析:
本题难度:简单