时间:2019-06-28 20:42:02
1、选择题 NA表示阿伏加德罗常数的值,下列说法中正确的是
A.2L0.5mol?L-1的NH4Cl溶液中含有NA个NH4+
B.18g?D2O中含有10NA个电子
C.1molNa2O2与足量的水反应生成O2转移NA个电子
D.32gO2和O3的混合物中含有的原子总数一定是2NA个
2、实验题 据报道,有一种叫Thibacillus Ferroxidans的细菌在氧气存在下,酸性溶液中,将黄铜矿氧化成硫酸盐:
4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3 +2H2O
(1)利用反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O): 
①溶液B显____(填“酸”“碱”或“中”)性,原因是___ (用离子方程式表示)。
②分析下表所提供的数据可知,加入CuO可除去CuSO4溶液中的Fe3+。 
请运用沉淀溶解平衡的有关理论解释加入CuO能除去CuSO4溶液中Fe3+的原因:____。
③操作a的名称是____,操作b的操作方法是____。
④检验溶液B中Fe3+是否被除尽的试剂是____,证明Fe3+已被除尽的现象是____。
(2)在实验室中,设计两个原理不同的方案,从溶液B中提炼金属铜(要求:一种方案只用一个反应来完成)。写出两种方案的化学方程式:方案一:____;方案二:____。
3、填空题 (2008年北京卷,理综,27)(3)用图示装置制备NO并验证其还原性。有下列主要操作: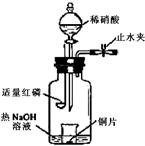
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作是___________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是? ____________________________________________________________________。
③步骤c滴入稀硝酸后烧杯中的现象是_____________________________________
______________________________________________________________________。反应的离子方程式是____________________________________________________。
4、填空题 CaCl2常用于冬季道路除雪,建筑工业的防冻等,实验室常用作干燥剂。工业上常用大理石(含有少量Al3+、Fe2+、Fe3+等杂质)来制备。下图为实验室模拟其工艺流程:
已知:常温下,溶液中的Fe3+、Al3+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,4,9.7。
(1)反应Ⅰ中,需将大理石粉碎、搅拌,同时适当加热,其目的是:?。写出反应Ⅰ中主要反应的离子方程式:?。
(2)上述使用盐酸的浓度为10%,若用37%的浓盐酸来配制500mL的此盐酸所需的玻璃仪器有:玻璃杯、量筒、烧杯、胶头滴管、?。
(3)反应Ⅱ中的离子方程式:?。
(4)反应Ⅲ中必须控制加入Ca(OH)2的量,使溶液的pH约为8.0,此时沉淀a的成分为:?,若pH过大,则可能发生副反应的离子方程式:?。
5、选择题 下列分离、提纯物质的方法正确的是
A.用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
B.分离汽油和水的混合物最好用蒸馏的方法
C.用分液的方法分离四氯化碳和水的混合物
D.用溶解、过滤的方法提纯含有少量BaCl2的NaCl