时间:2019-06-28 20:41:01
1、选择题 下列溶液中Cl-浓度最小的是?(?)
A.250mL 1mol/L AlCl3溶液
B.200mL 2mol/L MgCl2溶液
C.1L 2.5mol/L NaCl溶液
D.300mL 5mol/L KClO3溶液
参考答案:D
本题解析:根据化合物的化学式可知,ABC中Cl-浓度分别是(mol/L)3.0、4.0、2.5。选项D中氯酸钾不能电离出氯离子,因此答案选D。
本题难度:简单
2、选择题 VmL Al2(SO4)3溶液中含有Al3+ ag,溶液稀释到4V mL,则稀释后溶液中SO42-的物质的量浓度是
[? ]
A.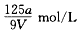
B.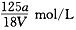
C.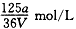
D.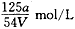
参考答案:A
本题解析:
本题难度:简单
3、选择题 下列说法正确的是(设阿伏加德罗常数的数值为6.02×1023)(? )。
A.在标准状况下,22.4 L苯所含分子数目为6.02×1023
B.1 mol/L K2SO4溶液所含K+数目为2×6.02×1023
C.在常温常压下,16 g 02和03的混合气体所含原子数目为6.02×1023
D.2.4 g Mg与足量盐酸完全反应时,失去电子数目为O.1x 6.02×1023
参考答案:C
本题解析:A:标准状况下苯为液体,不符合气体的摩尔体积,不正确
B:溶液没有体积,无法计算其中的微粒数目,不正确
C:混合气体均由氧元素组成,故16 g混合气体含有的氧原子一定为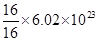 个,正确
个,正确
D:由Mg-2e-=Mg2+可知,2.4 g Mg与足量盐酸完全反应时,失去电子数目为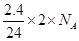 ,即O.2x 6.02×1023
,即O.2x 6.02×1023
答案为C
本题难度:一般
4、简答题 Ⅰ.下列实验方案不可行的是:______
A.用品红溶液鉴别CO2和SO2气体?B.用铜制容器盛放浓硝酸
C.用带玻璃塞的试剂瓶盛放NaOH溶液?D.用NH3和H2O做喷泉实验
E.除去?N2?中少量的O2用灼热的铜网?F.所有剩余的药品都不能放回原瓶
G.制Fe(OH)2时可将吸有NaOH溶液的滴管伸入到Fe?SO4溶液液面以下
Ⅱ.实验室制配0.5mol/L的NaOH溶液500mL.
(1)配制时,一般可分为以下几个步骤:①称量?②计算?③溶解?④摇匀⑤转移?⑥洗涤?⑦定容?⑧冷却.其正确的操作顺序为______.
(2)试分析下列操作对所配溶液的浓度有何影响.(填“偏高”、“偏低”或“无影响”)
①定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,对所配溶液浓度的影响______.
②某同学观察液面的情况如右图所示,则所配置的溶液的浓度______.
(3)取出其中50mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______.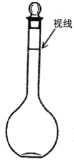
参考答案:Ⅰ.A.因SO2气体能使品红溶液褪色,而CO2气体不能使品红溶液褪色,故A错误;
B.因铜与放浓硝酸在常温下反应,所以不能用铜制容器盛放浓硝酸,故B正确;
C.因玻璃塞中二氧化硅与NaOH溶液发生反应生成硅酸钠,从而使玻璃塞和瓶口黏结在一起,所以放NaOH溶液的试剂瓶用橡皮塞,故C正确;
D.因NH3极易溶于H2O,所以NH3和H2O可做喷泉实验,故D错误;
E.因铜能与O2反应生成氧化铜,与N2不反应,所以可用灼热的铜网除去N2中少量的O2,故E错误;
F.因有些药品(如:钠等)用剩后要放回原瓶,故F正确;
故选:BCF;
Ⅱ.(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,故答案为:②①③⑧⑤⑥⑦④;
(2)①定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,滞留在刻度线以上的溶液会下落,溶液的体积偏大,浓度偏小,故答案为:偏低;
②定容时俯视观察液面,溶液的体积偏小,浓度偏大,故答案为:偏高;
(3)设稀释后溶液中NaOH的物质的量浓度为xmol/L,根据溶液稀释前后溶质质量不变则,0.5mol/L×0.05L=xmol/L×0.1L,解得x=0.25,故答案为:0.25mol/L.
本题解析:
本题难度:一般
5、选择题 NA表示阿伏加德罗常数,下列叙述正确的是
A.1L0.1mol?L-1的氨水含有0.1NA个OH―
B.1.7g H2O2中含有的电子数为0.9 NA
C.1mol Na2O2固体中含离子总数为4 NA
D.标准状况下,2.24L CCl4所含分子数为0.1 NA
参考答案:B
本题解析:A错,氨水中的一水合氨为弱电解质不能全部电离;B正确;C错,1mol Na2O2固体中含离子总数为3 NA;D错,标准状况下四氯化碳不是气体;
本题难度:一般