时间:2019-06-28 20:41:01
1、填空题 (6分)现有CO2和N2两种气体
(1)当二者的质量相等时,在相同状况下,体积比为 ?,密度之比为 ?,?分子数之比为 ?。
(2)在相同状况下,当二者的体积相同时,质量比为 ?,密度之比为 ?,?分子数之比为 ?。
参考答案:(每空1分,共6分)(1)7:11? 11:7? 7:11?(2)11:7? 11:7? 1:1
本题解析:(1)根据阿伏加德罗定律可知,在相同条件下,气体的体积之比是需要的物质的量之比。而在质量相等的条件下,气体的物质的量之比是摩尔质量之比的反比,所以CO2和氮气的体积之比是28︰44=7︰11;分子数之比也是7︰11;相同条件下气体的密度之比是相应的摩尔质量之比,即44︰28=11︰7;
(2)在相同状况下,当二者的体积相同时,气体的物质的量也是相同的,所以分子数之比是1︰1的,因此质量之比是44︰28=11︰7;相同条件下气体的密度之比是相应的摩尔质量之比,即44︰28=11︰7;
点评:在进行物质的量的有关计算时,关键是熟练应用几个关系式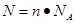 、n=m/M、
、n=m/M、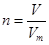 、
、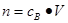 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
本题难度:简单
2、选择题 两种金属混合物粉末12g,与足量的盐酸反应生成标准状况下11.2L氢气,符合上述情况的金属混合物是
A.Mg、Fe
B.Zn、Ag
C.Al、Zn
D.Mg、Al
参考答案:C
本题解析:n(H2)=V/Vm=11.2L÷22.4L/mol=0.5mol.n(e-)=1mol.即12g的金属失去了1mol的电子,也就是说金属的平均摩尔电子质量为12g/mol.题干涉及的金属的摩尔电子质量分别是: M(Mg)e-="24g/2mol" ="12g/mol;M(Fe)e-=56g/2mol=28g/mol;M(Zn)e-=65g/2mol=32.5g/mol;M(Al)e-=27g/3mol=" 9g/mol; 由于Ag不能与酸发生置换反应,可以认为其摩尔电子质量无穷大。如果平均给出1mol的电子需要的质量为12g,则一种金属的摩尔电子质量比12g大,一种金属的摩尔电子质量比12g小。A.Mg:12g,Fe:28g,比平均12g大,不符合题意。错误。B.Zn:32. 5g,Ag:无穷大。比平均12g大,不符合题意。错误。C.Al:9g,Zn: 32. 5g,可以平均到12g/mol..符合题意。正确。D.Mg:12g.Al:9g。都比12g小。无论怎样混合都不可能平均到12g?mol.错误。
考点:考查金属混合物与酸反应置换出氢气的知识。
本题难度:一般
3、计算题 计算11.2 L下列气体在标准状况下的质量:
(1)N2和O2体积为4∶1的混合气体。
(2)N2的质量分数为20%的N2和O2的混合气体。
参考答案:(1)14.4 g
(2)15.56 g
本题解析:(1)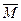 =80%×28+20%×32=28.8
=80%×28+20%×32=28.8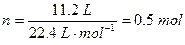
m="0.5" mol×28.8 g·mol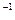 ="14.4" g
="14.4" g
(2)先求混合气体的平均摩尔质量: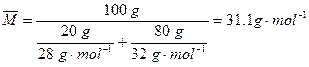
本题难度:简单
4、填空题 物质的量是化学中常用的物理量,请你利用学过的知识进行填空.
(1)SO2的摩尔质量是______;0.1molCO2的质量是______g,它在标准状况的体积约为______L;在0.5L0.2mol/L的Ba(NO3)2溶液中NO3-的物质的量浓度为______.
(2)在一定温度和压强下,5体积气体A2跟15体积的气体B2完全化合生成10体积某气体C,则该气体C的化学式为(用A、B表示)______.
(3)标准状况下4.48L某气体的质量为14.2g,该气体的摩尔质量为______.
(4)如果用10mol?L-1的浓盐酸配制250mL1mol?L-1的稀盐酸,需要量取______mL浓盐酸.
参考答案:(1)SO2的摩尔质量是64g/mol;0.1molCO2的质量=0.1mol×44g/mol=4.4g,它在标准状况的体积约为0.1mol×22.4L/mol=2.24L;在0.5L0.2mol/L的Ba(NO3)2溶液中NO3-的物质的量浓度=0.2mol/L×2=0.4mol/L,
故答案为:64g/mol;4.4;2.24;0.4mol/L;
(2)相同条件下,体积之比等于物质的量之比等于分子数之比,由于5体积气体A2跟15体积气体B2化合生成10体积某气体C,所以A2、B2、C的化学计量数之比为5体积:15体积:10体积=1:3:2,所以方程式为A2+3B2=2C,根据原子守恒可知C的化学式为AB3,
故答案为:AB3;
(3)标准状况下4.48L气体的物质的量=4.48L22.4L/mol=0.2mol,该气体的摩尔质量=14.2g0.2mol=71g/mol,
故答案为:71g/mol;
(4)令需要10mol?L-1的浓盐酸的体积为V,根据稀释定律,则:
10mol?L-1×V=250mL×1mol?L-1,解得V=25.0mL,
故答案为:25.0mL.
本题解析:
本题难度:一般
5、选择题 设NA为阿伏加德罗常数的值,下列说法正确的是
A.1mol NO2与足量H2O反应,转移电子数为2mol
B.1mol C5H12分子中含有的共价键数目为16NA
C.1L 0.5mol/LNa2CO3溶液中阴离子数目小于0.5mol
D.CO2通过Na2O2使其增重bg时,反应中转移的电子数为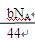
参考答案:B
本题解析:略
本题难度:一般