时间:2019-06-28 20:36:34
1、选择题 下列关于各实验装置图的叙述中,正确的是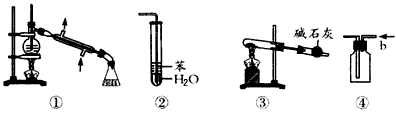
[? ]
A.装置①可用于制取少量的蒸馏水
B.装置②可用于吸收NH3,并防止倒吸
C.以NaHCO3为原料,装置③可用于实验室制取少量CO2
D.装置④b口进气可收集Cl2
参考答案:A
本题解析:
本题难度:一般
2、选择题 如图是一套实验室制气装置,用于发生、干燥和收集气体.?下列各组物质中能利用这套装置进行实验的是( )
A.铜屑和浓硝酸
B.二氧化锰和浓盐酸
C.锌和稀硫酸
D.碳酸钙和稀盐酸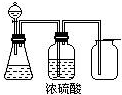
参考答案:D
本题解析:
本题难度:一般
3、选择题 右图装置可用于( )
A.加热NaHCO3制CO2
B.用Cu与稀HNO3反应制NO
C.用NH4Cl与浓NaOH溶液反应制NH3
D.实验室用KMnO4制氧气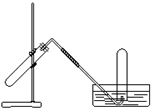
参考答案:B
本题解析:
本题难度:一般
4、简答题 现有如下仪器,仪器中已注入溶液,回答下列问题.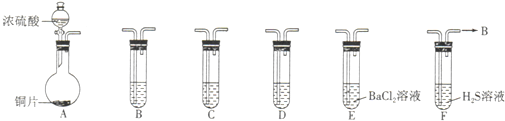
(1)加热装置A,写出铜与浓硫酸反应的化学方程式:______,烧瓶中的实验现象为______.
(2)验证碳、硅非金属性的相对强弱(已知酸性:H2SO3>H2CO3),若选择仪器A、B、C、D并相连接,则B、C、D中所选择的试剂分别为______、______、______.能说明碳的非金属性比硅强的实验现象是______.
(3)验证SO2的氧化性、还原性.若选择A、E、F仪器,并按A、E、F顺序连接.
①则证明SO2有氧化性的实验现象是______,反应方程式为:______.
②若证明SO2具有还原性,在E中采取的实验操作为______,其实验现象为______,反应原理为______.
参考答案:(1)铜跟浓硫酸反应,铜具有还原性,浓硫酸具有强氧化性,反应必须加热才能发生,书写化学方程式为:Cu+2H2SO4(浓)△.CuSO4+2H2O+SO2↑,由于有气体二氧化硫生成,故在铜表面有气泡冒出,由于浓硫酸具有氧化性,可能有氧化铜生成,铜片变黑色,浓硫酸具有吸水性,生成的无水硫酸铜呈白色,故答案为:Cu+2H2SO4(浓)△.CuSO4+2H2O+SO2↑,铜片变灰黑色表面有气泡生成,烧瓶中可能有白色物质生成;
(2)装置A的作用是除去二氧化硫,装置B的作用是产生二氧化碳,可用碳酸钠或碳酸氢钠,装置C的作用是除去二氧化硫,可以利用强氧化性物质如:酸性高锰酸钾溶液,可防止干扰二氧化碳与硅酸钠溶液的反应,装置D的作用是证明碳酸酸性比硅酸强,选择可溶性硅酸盐,如硅酸钠溶液;利用强酸制备弱酸,酸性越强,最高价氧化物水化物的酸性越强,中心元素的非金属性越强原理,故看到的现象为C中KMnO4溶液不褪色,D中出现白色沉淀;
故答案为:Na2CO3溶液或 NaHCO3溶液;KMnO4 溶液;Na2SiO3溶液;C中KMnO4溶液不褪色,D中出现白色沉淀;
(3)①H2S溶液中二氧化硫与硫化氢反应生成硫单质与水,二氧化硫的化合价降低作为氧化剂,具有氧化性,所以看到淡黄色浑浊出现,
反应离子方程式为:2H2S+SO2=3S↓+2H2O,
故答案为:H2S溶液中有浅黄色混浊出现; 2H2S+SO2═3S↓+2H2O;
②要证明二氧化硫具有还原性,可把二氧化硫氧化成硫酸,通过检验硫酸根离子来证明,故可把二氧化硫通入氯化钡溶液中不反应,滴加氯水或高锰酸钾或过氧化氢等氧化剂把二氧化硫氧化成硫酸,硫酸与氯化钡反应生成硫酸钡,涉及方程式为Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-,
故答案为:通入氯气(或加入氯水或加入过氧化氢溶液,或高锰酸钾溶液等氧化剂);白色沉定生成;Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-.
本题解析:
本题难度:一般
5、选择题 下列装置或操作能达到实验目的是( )
A.A是实验室制氧气装置
B.B是收集CO2气体的装置
C.C是检查装置的气密性
D.D是分离酒精和水的装置
参考答案:C
本题解析:
本题难度:一般