时间:2019-06-28 20:27:37
1、选择题 下列说法正确的是
[? ]
A.离子键具有饱和性和方向性
B.在形成离子键时,原子总是尽可能沿着原子轨道最大重叠的方向成键
C.s轨道与s轨道之间可以在任何方向上成键,所以共价键没有方向性
D.s轨道与p轨道只有沿着一定的方向,才能发生最大程度的重叠,形成共价键
参考答案:D
本题解析:
本题难度:简单
2、选择题 不锈钢的种类很多,其中一种铁元素以外,还含有较多的Cr(铬)、Ni(镍)、Mo(钼),少量的Si(硅)、C(碳),微量的S(硫)、P(磷)。
(1)上述元素中属于第三周期且第一电离能从大到小排列的是_______
(2)Mo(钼)处于第五周期,且与Cr(铬)元素位于同一族,则基态Mo(钼)原子的外围电子(价电子)排布式是_______。
(3)CH4的沸点比SiH4低,原因是_______。
(4)镍元素能形成多种配合物,配离子[Ni(CN)4]2—中不含有的是____(填选项编号)。
A.离子键
B.配位键
C.σ键
D.π键E.氢键
(5)碳元素有多种单质,其中C60分子有独特的球形结构:C60分子中原子轨道杂化类型是_______。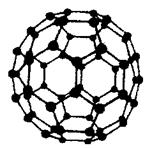
(6)碳的另一种单质石墨呈层状结构,有一碳镁新型材料就是在石墨碳原子层间加人镁原子层,两层俯视图: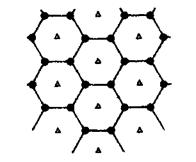
该材料的化学式为_______。
参考答案:(13分)
(1)P、S、Si(2分)
(2)4d55s1(2分)
(3)CH4与SiH4组成、结构相似,CH4的相对分子质量较小,分子间范德华力也较小,故其沸点较低(2分)
(4)A? E(2分)
(5)sp2(2分)
(6)MgC2(3分)
本题解析:(1)Si、P、S是第三周期从左到右的主族元素,则第一电离能总体递增,但是原子轨道半充满电子的P比相邻元素大,则P>S>Si;(2)基态Cr原子的价电子排布式为3d54s1,则位于第五周期的Mo原子价电子排布式为4d55s1;(3)CH4与SiH4组成、结构相似,CH4的相对分子质量较小,分子间范德华力也较小,故其沸点较低;(4)[Ni(CN)4]2—的中心离子和配体之间存在配位键、配体内C和N之间C≡N键中存在1个σ键和2个π键,不存在离子键和氢键,故AE正确;(5)C60分子中碳原子之间可以形成正六边形和正五边形,其中正六边形中∠CCC=120?,说明碳原子采取sp2杂化;(6)以任意1个正六边形为研究对象,每个顶点被相邻3个正六边形公用,每个正六边形含有的碳原子数=6×1/3=2,镁原子数为1×100%=1,则每个正六边形或材料的化学式为MgC2。
本题难度:一般
3、选择题 根据元素周期律和周期表,下列各项叙述正确的组合是:①同一主族元素,原子半径越大,非金属单质的熔点一定越高;②同一周期元素的原子(除稀有气体),半径越大越容易失去电子;③若R2-和M+的电子层结构相同,则微粒半径:M+>R2-;④原子半径X小于Y的同一主族的两种元素,若X(OH)n是强碱,则Y(OH)n也是强碱;⑤除第一周期外,第n周期的最后一种金属元素位于第n主族( )
A.①②④
B.①③⑤
C.②③④
D.②④⑤
参考答案:①同一主族元素,非金属单质的熔点与晶体结构有关,金属晶体族原子半径越大,金属单质的熔点越小,晶体结构相同的卤族原子半径越大,非金属单质的熔点越高,故①错误;
②同一周期元素的原子(除稀有气体)自左而右原子半径减小,金属性减弱,故半径越大越容易失去电子,故②正确;
③若R2-和M+的电子层结构相同,核电荷数R>M,核电荷数越大,离子半径越小,故微粒半径:M+<R2-,故③错误;
④原子半径X小于Y的同一主族的两种元素,原子序数Y>X,若X(OH)n是强碱,则金属性Y>X,则Y(OH)n也是强碱,故④正确;
⑤除第一周期外,当最外层电子数>周期数为非金属元素,每周期的最后一种金属元素为主族元素,且最外层电子数=周期数,故第n周期的最后一种金属元素位于第n主族,故⑤正确;
故选D.
本题解析:
本题难度:一般
4、选择题 叠氮化钠(NaN3)是无色离子晶体,遇高热或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一。下列有关说法正确的是
A.NaN3中含有离子键
B.1 mol NaN3完全分解最多可以产生33.6L N2
C.当有4.2g N2生成时,转移电子数约为6.02×1022
D.常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项
参考答案:C
本题解析:A项,N3-中还存在非极性共价键;B项,因没给出气体所处状态,故无法确定放出气体的体积;C项,当有4.2 g N2生成时,即有0.1 mol:NaN3发生分解反应,故可知转移电子数约为6.02×1023;D项,由信息知NaN3化学性质不稳定,应在外包装盒上注明低温保存,不能剧烈震动,小心搬移等。
本题难度:一般
5、填空题 卤素性质活泼,能形成卤化物、多卤化物等多种类型的化合物。
(1)卤化氢中,HF的沸点高于HCl,原因是____________________________
____________________________________________。
(2)如图为F-与Mg2+、K+形成的某种离子晶体的晶胞,其中“○”表示的离子是________(填离子符号)。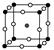
(3)多卤化物Rb[ICl2]分解时生成晶格能相对较大的铷(Rb)的卤化物,则该卤化物的化学式为_______________。
(4)BF3与NH3能发生反应生成X(H3BNF3),X的结构式为____________(用“→”表示出配位键):X中B原子的杂化方式为____________________________。
(5)有一类物质的性质与卤素类似,称为“拟卤素”[如(SCN)2、(CN)2等]。(CN)2的结构式为CNCN,该分子中σ键和π键数目之比为________。
参考答案:(1)HF分子间形成氢键 (2)F- (3)RbCl
(4) 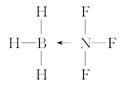 sp3杂化 (5)3∶4
sp3杂化 (5)3∶4
本题解析:(1)HF、HCl均为分子晶体,其中HF能形成分子间氢键,使沸点升高。(2)由晶胞结构可知,黑球有1个,灰球有1个,白球有3个,由电荷守恒可知离子数关系为N(Mg2+)∶N(K+)∶N(F-)=1∶1∶3,得白球为F-。(3)分解时可形成RbI或RbCl两种卤化物,由于r(Cl-)<r(I-),所以后者晶格能大。(4)注意B为ⅢA族元素,最外层只有3个电子,有1个空轨道,N为VA族元素,有一对孤对电子,写出结构式。B原子形成4根键,即0+4=4,sp3杂化。(5)叁键中有1个σ键、2个π键,单键均为σ键。
本题难度:一般