时间:2019-06-28 20:27:37
1、选择题 下列叙述中正确的是( )
A.NH3、CO、CO2都是极性分子
B.CH4、CCl4都是含有极性键的非极性分子
C.HF、HCl、HBr、HI的稳定性依次增强
D.CS2、H2O、C2H2都是直线形分子
2、填空题 (8分,每空2分)自从1962年首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙气的一系列化合物如XeF2、XeF4等。巴特列为开拓稀有气体化学作出了历史性贡献。
(1)请根据XeF4的结构示意图判断这个分子是极性分子还是非极性分子?_________?。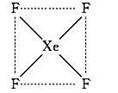
(2)XeF2晶体是一种无色晶体,下图为它的晶胞结构图。XeF2晶体属于哪种类型的晶体?_________;其堆积方式属于__________(填“钾型”“镁型”或“铜型”)。
(3)一个XeF2晶胞中实际拥有XeF2__________个。
3、选择题 下列各种元素的原子序数,期中能组成化学式为XY2型离子化合物的是( )
A.6和8
B.16和8
C.12和17
D.11和16
4、填空题 (8分)有下列八种晶体:
A.(水晶)SiO2
B.冰醋酸
C.氧化镁
D.白磷 E.固体氩
F.氢氧化钠 ? G.铝 ? H.金刚石
用序号回答下列问题:
(1) 属于原子晶体的化合物是_________;晶体中含有氢键的是________。
(2) 由极性分子构成的晶体是_________;由正四面体形分子构成的晶体是____;
?含有共价键的离子晶体是________。
(3) 在一定条件下能导电而不发生化学变化的是___________;晶体中只含有范德华
力一种作用的是___________;受热熔化需克服共价键的化合物是___________。
5、选择题 下列对分子性质的解释中,不正确的是
A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B.由于乳酸(  )中存在一个手性碳原子,导致该物质存在互为镜像的两个
)中存在一个手性碳原子,导致该物质存在互为镜像的两个
手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子
C.HF的稳定性很强,是因为其分子间能形成氢键
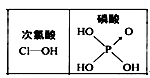
D.由下图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子