时间:2019-06-28 20:09:35
1、选择题 相同状况下,在容积相同的三个烧瓶内,分别充满干燥的NH3、HCl与空气1:1的混合气体、NO2气体.然后分别做喷泉实验,实验结束后,烧瓶内3种溶液的物质的量浓度之比为(假设溶质不向外扩散)( )
A.3:3:2:
B.1:1:1:
C.2:2:3:
D.无法比较
参考答案:在容积相同的三个烧瓶内,分别充满干燥的NH3、HCl与空气1:1的混合气体、NO2气体.
所以V(NH3):V(HCl):V(NO2)=2:1:2.
相同条件下,体积之比等于物质的量之比,
所以n(NH3):n(HCl):n(NO2)=V(NH3):V(HCl):V(NO2)=2:1:2.
令n(NH3)=2mol、n(HCl)=1mol、n(NO2)=2mol,各自体积为V(NH3)=2L、V(HCl)=1L、V(NO2)=2L.
对于氨气,溶液体积等于氨气气体体积,所以c(NH3)=2mol2L=1mol/L;
对于氯化氢,溶液体积等于氯化氢气体体积,所以c(HCl)=1mol1L=1mol/L;
对于二氧化氮,与水发生反应:3NO2+2H2O=2HNO3+NO,根据方程式可知溶液体积为二氧化氮体积的23,生成的硝酸的物质的量为二氧化氮物质的量的23,所以c(HNO3)=23×2mol23×2L=1mol/L.
所以c(NH3):c(HCl):c(HNO3)=1:1:1.
故选B.
本题解析:
本题难度:简单
2、选择题 设NA为阿伏加德罗常数的数值,下列说法正确的是
A.常温下,18g水中含有NA个氢原子
B.一个水分子的质量是18/NAg
C.标准状况下,11.2L水所含分子数为0.5 NA
D.含有原子总数为0.1NA的水的质量为1.8g
参考答案:B
本题解析:A、18g水的物质的量是1mol,1个水分子中含有2个H原子,所以18g水中氢原子的个数是2NA,错误;B、NA个水分子的质量是18g,则1个水分子的质量是18/NAg,正确;C、标准状况下,水不是气体,所以11.2L的水的物质的量不是0.5mol,错误;D、1个水分子中含有3个原子,则原子总数是0.1NA的水的个数是0.1NA/3,物质的量是0.1/3mol,所以该水的质量是0.6g,错误,答案选B。
考点:考查阿伏伽德罗常数的应用
本题难度:一般
3、填空题 9.03×10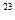 个氨分子含?摩氮原子,?摩氢原子,?摩质子,?个电子。
个氨分子含?摩氮原子,?摩氢原子,?摩质子,?个电子。
参考答案:1.5? 4.5? 15? 15×6.02×10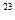
本题解析:解此题思路是用“物质的量”作桥梁,通过阿伏加德罗常数来过渡。
(1)首先要求氨分子的物质的量,即9.03×10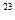 ÷6.02×10
÷6.02×10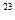 mol
mol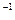 ="1.5" mol
="1.5" mol
(2)氨分子的化学式是NH3,一个NH3分子是由一个氮原子和三个氢原子构成,则1 mol NH3应由1 mol N和3 mol H构成。即1.5 mol NH3含1.5 mol N、4.5 mol H。
(3)1 mol NH3含10 mol质子、10 mol电子,则1.5 mol NH3含15 mol质子、15 mol电子。
(4)1 mol电子含6.02×10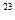 个电子,则15 mol电子含15×6.02×10
个电子,则15 mol电子含15×6.02×10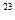 个电子。
个电子。
本题难度:简单
4、选择题 质量分数为90%的硫酸溶液和10%的硫酸溶液等体积混合后,溶液中溶质的质量分数(? )
A.大于50%
B.等于50%
C.小于50%
D.不能作上述比较
参考答案:A
本题解析:显然,当90%的硫酸溶液和10%的硫酸溶液以等质量混合所得溶液的质量分数为: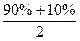 =50%
=50%
质量分数为90%的硫酸溶液和10%的硫酸溶液的密度大小关系为:90%的硫酸溶液>10%的硫酸溶液。
所以等体积(不是等质量)的这两种硫酸溶液的总质量:90%的硫酸溶液>10%的硫酸溶液,那么,混合后所得溶液的质量分数必定大于50%。
本题难度:简单
5、选择题 下列关于0.05mol /L的K2SO4溶液的说法中,正确的是
A.1L溶液中含有K+、SO42-总数为0.03NA
B.1L溶液中含有K+数目是0.1NA
C.1 L溶液中K+的浓度是0.20 mol / L
D.2 L溶液中含有SO42-的浓度是0.3mol / L
参考答案:B
本题解析:在0.05mol /L的K2SO4溶液中K+的浓度是0.10 mol / L、SO42-的浓度是0.05mol / L,而与溶液体积无关,排除CD选项;在1L的0.05mol /L的K2SO4溶液中,K+数目为0.05×2×1×NA=0.1NA,SO42-个数为0.05NA,两者总数为0.15NA,故答案为B
本题难度:一般