时间:2019-06-28 20:09:35
1、选择题 摩尔是
A.国际单位制的一个基本物理量
B.物质质量的单位
C.物质的量的单位
D.表示6.02×1023个粒子的集体
参考答案:C
本题解析:物质的量是国际单位制中一个基本物理量,而摩尔是其单位。
本题难度:简单
2、选择题 下列判断正确的是 (? )
A.1L H2SO4溶液中含有98g H2SO4,则该溶液的物质的量浓度为98g/L
B.1LH2O中溶解了0.5molNaCl,则该溶液的物质的量浓度为0.5mol/L
C.从1L 1mol/L 蔗糖溶液中取出100mL溶液,其物质的量浓度仍为1mol/L
D.0.5mol/L 的NaOH溶液中,含有0.5mol Na+
参考答案:C
本题解析:1L H2SO4溶液中含有98g H2SO4,该溶液的物质的量浓度为1mol/L,A错误;1LH2O中溶解了0.5molNaCl,溶液体积未知,浓度无法计算,B错误;溶液具有均一性,从1L 1mol/L 蔗糖溶液中取出100mL溶液,其物质的量浓度仍为1mol/L,C正确;0.5mol/L 的NaOH溶液中,钠离子浓度为0.5mol/L,D错误。
点评:溶液的体积不等于水的体积,也不等于溶质与溶剂体积之和。
本题难度:一般
3、选择题 设NA表示阿伏加德罗常数的数值。下列有关叙述正确的是(?)。
A.标准状况下,2.24 L庚烷含有的分子数等于0.1 NA
B.常温下,100 mL 1 mol·L-1 Na2CO3溶液中阴离子总数为0.1 NA
C.分子数为NA的CO、C2H4的混合气体体积约为22.4 L,质量为28 g
D.3.4 g NH3中含N—H键数目为0.6 NA
参考答案:D
本题解析:标准状况下,庚烷为液体,不能根据体积计算其物质的量;由于
CO32-能够发生水解,因此常温下,100 mL 1 mol·L-1 Na2CO3溶液中阴离子总数大于0.1 NA;C项未标明气体的状态,无法确定其物质的量;1个NH3分子中含有3个N—H键,3.4 g NH3中含N—H键数目为0.6 NA。
本题难度:一般
4、计算题 (13分)在标准状况下,将22.4L HCl 气体溶于63.5mL水中,所得盐酸的密度为1.18g/cm3。
回答下列问题:
(1)所得盐酸的质量分数浓度和物质的量浓度(列式计算)?
(2)现需480mL2.0mol/L的盐酸需用量筒量取?mL上述盐酸并选用?mL的容量瓶来配制;若配制过程中洗涤量取上述盐酸的量筒,并将洗涤液转移到容量瓶,则所配盐酸的浓度?2.0mol/L(填>、<或=)。
(3)现取不纯的Na2CO3样品ag(含少量NaHCO3和H2O)于100mL2.0mol/L过量的盐酸中,充分反应后,再加入50mL1.0mol/L的NaOH溶液后呈中性。蒸发中和后的溶液最终得到固体?g。
参考答案:(1)(4分)? 36.5%? 11.8mol/L?(只要写成主要量方程计算即可)
(2)(6分)? 84.7 ;500 ;>?;(3)(3分)? 11.7
本题解析:(1)标准状况下,22.4L HCl 气体的物质的量是22.4L÷22.4L/mol=1.0mol,质量是36.5g。所以溶液的质量是63.5g+36.5g=100g,所以溶液的质量分数是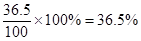 ;溶液的体积是100g÷1.18g/ml=84.75ml,所以浓度是
;溶液的体积是100g÷1.18g/ml=84.75ml,所以浓度是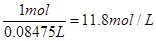 。
。
(2)由于容量瓶的规格没有480ml的,所以应该配制500ml,则需要浓盐酸的体积是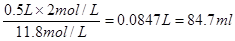 ;若配制过程中洗涤量取上述盐酸的量筒,并将洗涤液转移到容量瓶,则溶质的物质的量将增加,导致浓度偏高。
;若配制过程中洗涤量取上述盐酸的量筒,并将洗涤液转移到容量瓶,则溶质的物质的量将增加,导致浓度偏高。
(3)最终溶液中的溶质是氯化钠,根据钠原子守恒可知,氯化钠的物质的量是0.05L×1.0mol/L=0.05mol,所以质量是0.05mol×58.5g/mol=11.7g。
本题难度:一般
5、填空题 (1)相同物质的量的CO2和O2,原子数目之比为 ,氧原子数目之比为 ;质量相同的CO2和O2,其物质的量之比为 。
(2)20.6 g NaR含有Na+0.2 mol,则NaR的摩尔质量为 g·mol-1,则含R 8.0 g的NaR的物质的量为 mol。
参考答案:(1)3∶2 1∶1 8∶11 (2)103 0.1
本题解析:(1)每个CO2分子含有3个原子,每个O2分子含有2个原子,所以相同物质的量的CO2和O2,原子数目之比为3∶2;每个CO2分子含有2个氧原子,每个O2分子含有2个氧原子,所以相同物质的量的CO2和O2,氧原子数目之比为1∶1;根据n=m/M,可知相同质量,物质的量与摩尔质量成反比,质量相同的CO2和O2,其物质的量之比为32∶44=8∶11。
(2)20.6 g NaR含有Na+为0.2 mol,故NaR为0.2 mol,根据M=m/n计算NaR的摩尔质量为20.6 g÷0.2 mol="103" g·mol-1;R的摩尔质量为103 g·mol-1-
23 g·mol-1="80" g·mol-1,8.0 g R的物质的量为8.0 g/80 g·mol-1="0.1" mol,NaR的物质的量等于R的物质的量,所以含R 8.0 g的NaR的物质的量为0.1 mol。
考点:物质的量的计算、阿伏伽德罗常数的意义。
本题难度:一般