时间:2019-06-25 23:32:29
1、填空题 (14分)常温下钛的化学活性很小,在较高温度下可与多种物质反应。工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:
(1)TiCl4遇水强烈水解,写出其水解的化学方程式 。
(2)①若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
②Cl2含量检测仪工作原理如下图,则Cl2在Pt电极放电的电极反应式为 。
③实验室也可用KClO3和浓盐酸制取Cl2,方程式为:KClO3 + 6HCl(浓) =" KCl" + 3Cl2↑+ 3H2O。
当生成6.72LCl2(标准状况下)时,转移的电子的物质的量为 mol。
(3)一定条件下CO可以发生如下反应:4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g) △H。
CH3OCH3(g)+H2O(g) △H。
①该反应的平衡常数表达式为K= 。
②将合成气以n(H2)/n(CO)=2通入1 L的反应器中,CO的平衡转化率随温度、压强变化关系如图所示,下列判断正确的是 (填序号)。
a.△H <0
b.P1<P2<P3
c.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
③采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(简称DME)。观察下图回答问题。
催化剂中n(Mn)/n(Cu)约为 时最有利于二甲醚的合成。
参考答案:(14分)
(1)TiCl4 + 4H2O=Ti(OH)4↓+ 4HCl↑或TiCl4 + 3H2O=H2TiO3↓+ 4HCl↑(2分)
(2)①铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用 (2分)
②Cl2 + 2e- + 2Ag+ ="=" 2AgCl (2分) ③0.5 (2分)
(3)①c(CH3OCH3)c(H2O)/[c(H2)4c(CO)2] (2分)
②a(2分) ③2.0 (2分,1.9~2.1均给分)
本题解析:(1) TiCl4遇水强烈水解,生成氯化氢和氢氧化钛,化学方程式是TiCl4 + 4H2O=Ti(OH)4↓+ 4HCl↑;或TiCl4 + 3H2O=H2TiO3↓+ 4HCl↑;
(2)①氯气与钢瓶中的铁反应生成的氯化铁对氯气与苯的反应有催化作用,所以钢瓶表面氯与苯的反应明显加快;
②根据图可知,银离子向通入氯气的一极移动,说明通入氯气的一极是阴极,所以氯气得到电子生成氯离子与银离子反应生成氯化银沉淀,电极反应式是Cl2 + 2e- + 2Ag+ ="=" 2AgCl;
③根据KClO3 + 6HCl(浓) =" KCl" + 3Cl2↑+ 3H2O,当生成6.72LCl2(标准状况下)物质的量是0.3mol时,消耗氯酸钾的物质的量是0.1mol,氯酸钾中Cl元素的化合价从+5价降低到0价,得到5个电子,则0.1mol氯酸钾参加反应得到电子的物质的量是0.5mol,所以该过程中转移的电子的物质的量为0.5mol;
(3)①根据平衡常数的定义,可知该反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/[c(H2)4c(CO)2];
②a、压强一定时,温度升高,CO的转化率降低,说明升高温度,平衡逆向移动,则该反应是放热反应,△H <0,正确;b、压强增大,平衡正向移动,则CO的转化率增大,所以P1>P2>P3,错误;c、若在P3和316℃时,起始时n(H2)/n(CO)=3,即增大氢气的浓度而CO的浓度不变,则平衡正向移动,所以达到平衡时CO的转化率增大,大于50%,错误,答案选a;
③根据图可知,当CO的转化率最大、DME的选择性最大值时对应的横坐标大约在2.0附近,所以n(Mn)/n(Cu)约为2.0时最有利于二甲醚的合成。
考点:考查对物质性质的分析,化学平衡移动的判断,对图像的分析判断
本题难度:困难
2、选择题 下列各物质中,不能发生水解反应的是( )
A.纤维素
B.蛋白质
C.油脂
D.葡萄糖
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列水解离子方程式正确的是:
A.CO32-+H2O CO2 +2OH-
CO2 +2OH-
B.I-+H2O HI+OH-
HI+OH-
C.SO32-+2H2O H2SO3+2OH-
H2SO3+2OH-
D.HPO42- +H2O H2PO4- +OH-
H2PO4- +OH-
参考答案:D
本题解析:A中CO32-水解分布进行,且不可能生成CO2,不正确;B中I-不水解,不正确;C中SO32-水解分布进行,不正确,答案选D。
考点:考查水解方程式的判断
点评:该题是基础性试题的考查,侧重对学生基础知识的巩固和训练。该题的关键是明确盐类水解的含义以及特点,然后灵活运用即可,难度不大。
本题难度:一般
4、选择题 根据右表,以下错误的是
| 酸 | HF | H3PO4 |
| 电离常数 | Ki =" 3.6×10" - 4 | Ki1=" 7.5×10" -3 Ki2=" 6.2×10" -8 Ki3=" 2.2×10" -13 |
参考答案:C
本题解析:根据表格提供的数据可知HF的电离平衡常数小于H3PO4的一级电离平衡常数,大于H3PO4的二级电离平衡常数,所以根据强酸制取弱酸的性质可知,NaF和H3PO4反应的产物只有HF、NaH2PO4,正确;B.Na3PO4 、Na2HPO4 、NaF、NaH2PO4都是强碱弱酸盐。弱酸根离子发生水解反应而消耗水电离产生的H+,是溶液显碱性。酸的电离平衡常数越小,相应的酸根离子水解程度就越大,溶液的碱性就越强,pH就越大。由于HF的电离平衡常数小于H3PO4的一级电离平衡常数,大于H3PO4的二级电离平衡常数,H3PO4的二级电离平衡常数大于H3PO4的三级电离平衡常数,所以等浓度的这几种盐溶液的pH由大到小的顺序是Na3PO4>Na2HPO4>NaF>NaH2PO4,正确;C.H3PO4是三元弱酸,电离分步进行。主要发生第一不电离。H3PO4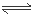 H++H2PO4-。而且第一步的电离会对第二、第三步的电离平衡起抑制作用。假设发生该步电离产生的H+的浓度是x,则K=
H++H2PO4-。而且第一步的电离会对第二、第三步的电离平衡起抑制作用。假设发生该步电离产生的H+的浓度是x,则K=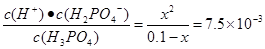 。解得x=2.74×10-2mol/L<0.1mol/L,错误;D.在两种溶液中微粒都存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(F-);c(Na+)+c(H+)=c(OH-)+c(H2PO4-);每种溶液中含有的离子都是Na+和H+浓度的2倍。在NaF和NaH2PO4溶液中都存在阴离子的水解作用。两种盐的浓度相等,所以c(Na+)相等。根据电离平衡常数可知水解程度NaF> NaH2PO4,所以溶液中的c(OH-):NaF> NaH2PO4,则根据水的离子积常数可知溶液中溶液中c(H+):NaH2PO4> NaF,所以在25℃时,等体积、等浓度的NaF和NaH2PO4溶液中所含离子总数前者小于后者,正确。
。解得x=2.74×10-2mol/L<0.1mol/L,错误;D.在两种溶液中微粒都存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(F-);c(Na+)+c(H+)=c(OH-)+c(H2PO4-);每种溶液中含有的离子都是Na+和H+浓度的2倍。在NaF和NaH2PO4溶液中都存在阴离子的水解作用。两种盐的浓度相等,所以c(Na+)相等。根据电离平衡常数可知水解程度NaF> NaH2PO4,所以溶液中的c(OH-):NaF> NaH2PO4,则根据水的离子积常数可知溶液中溶液中c(H+):NaH2PO4> NaF,所以在25℃时,等体积、等浓度的NaF和NaH2PO4溶液中所含离子总数前者小于后者,正确。
考点:考查电离平衡常数在物质发生反应的产物的确定及溶液中微粒浓度大小比较中的应用的知识。
本题难度:一般
5、选择题 能使Na2CO3溶液中Na+与CO32-更接近2∶1的措施是
A.加水
B.加Na2CO3粉末
C.加KOH固体
D.加热
参考答案:C
本题解析:
本题难度:简单