时间:2019-06-25 23:32:29
1、填空题 某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol·L-1的MgCl2溶液中各加入10滴2 mol·L-1 NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4 mL 2 mol·L-1 HCl 溶液 | 沉淀溶解 |
| Ⅱ | 4 mL 2 mol·L-1 NH4Cl 溶液 | 沉淀溶解 |
2、填空题 (10分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸和冶炼钢铁的重要原料。高温下可发生反应:
3FeS2+8O2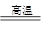 6SO2+Fe3O4
6SO2+Fe3O4
该过程中若有1.5mol FeS2参加反应,则反应过程中转移_____mol电子。
(2)氯化铁溶液显酸性,原因是___________________(用适当的文字和离子方程式解释),用惰性电极电解氯化铁溶液之初,阳极电极反应式为:____________________________________。
(3)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为: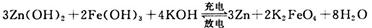
放电时电池的负极反应式为____________________;充电时电解液的pH________(填“增大”“减小”或“不变”之一)。
3、选择题 设NA为阿伏伽德罗常数的值。下列说法正确的是
A.200 mL1 mol Al2(SO4)3溶液中,Al3+和SO42—离子数的总和为NA
B.标准状况下,2.24 L乙醇中含有的C—H键数目为0.5NA
C.0.1 mol Na完全被氧化生成Na2O2,转移电子的数目为0.1NA
D.0.1 mol O2和O3的混合气体中含氧原子数目为0.2NA
4、选择题 下列电离或水解方程式正确的是
A.Na2SO3的水解:SO32-+ 2H2O H2SO3 + 2OH-
H2SO3 + 2OH-
B.NaHCO3的电离:NaHCO3  Na + + H+ + CO32-
Na + + H+ + CO32-
C.KHS溶液中HS-的电离:HS-+ H2O  H3O+ + S2-
H3O+ + S2-
D.NaClO溶液与FeCl2溶液混合:2ClO- + Fe2+ + 2H2O =" 2HClO" + Fe(OH)2↓
5、选择题 甲、乙、丙三瓶等体积、等物质的量浓度盐酸溶液,若将甲蒸发掉-半水,在乙中加入少量醋酸钠固体,丙不变,然后用同浓度的NaOH滴定至完全反应后,所需溶液的体积是
A.甲=丙>乙
B.丙>乙>甲
C.丙=乙>甲
D.甲=乙=丙