时间:2019-06-25 22:50:04
1、选择题 2008年北京奥运会“祥云”火炬用的是环保型燃料——丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为: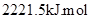 -1,下列有关说法正确的是(?)
-1,下列有关说法正确的是(?)
A.奥运火炬燃烧主要是将化学能转变为热能和光能
B.丙烷的沸点比正丁烷高
C.丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的正极
D.丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);△H=-2221.5kJ/mol
参考答案:A
本题解析:丙烷的碳原子数小于丁烷的,所以沸点低于丁烷的,B不正确。原电池负极失去电子,所以丙烷再负极通入,C不正确。燃烧热是指再一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,水的稳定状态是液态,D不正确,答案选A。
本题难度:一般
2、选择题 随着能源危机影响的加剧,全球寻找新能源的步伐加快,下列几种能源中不属于新能源的是
A.石油
B.风能
C.太阳能
D.潮汐能
参考答案:A
本题解析:新能源指太阳能、地热能、风能、海洋能、生物质能、核聚变能等,B、C、D属于新能源;石油属于化石能源,符合题意。
考点:考查新能源。
本题难度:一般
3、填空题 (7分)常温下,两种溶液:①0.1 mol/L HAC?②0.1 mol/L NaAC。
(1)溶液①的pH?7(填“>”、“<”或“=”),溶液中离子的电荷守恒的关系式是?。
(2)溶液②呈?性(填“酸”、“碱”或“中”)。其原因是?(用离子方程式表示)。
(3)两种溶液中c(AC-)的大小为?(填序号)。
a. 两种溶液中c(AC-)都等于0.1 mol/L
b. 两种溶液中c(AC-)都小于0.1 mol/L
c. HAC溶液中c(AC-)小于NaAC溶液中c(AC-)
(4)若将①②两溶液按一定的量混合,混合后溶液显中性,则①②两溶液的体积关系是:①?②(填“=”或“>”或“<”)
参考答案:(共7分)?(1)<;c(H+)=c(AC-)+c(OH-)
(2)碱;AC-+H2O HAC+OH-? AC-水解显碱性
HAC+OH-? AC-水解显碱性
(3)bc(2分,错选不得分)?(4)<
本题解析:(1)HAc是弱酸,溶液显酸性,pH小于7。根据电荷守恒可知,溶液中离子的电荷守恒的关系式是c(H+)=c(AC-)+c(OH-)。
(2)由于HAc是弱酸,所以NaAC水解,溶液显碱性。水解方程式为AC-+H2O HAC+OH-。
HAC+OH-。
(3)弱酸存在电离平衡,但大部分是没有电离的。NaAC中存在AC-的水解平衡,但大部分是没有水解的,所以正确的答案选bc。
(4)如果二者是等体积混合,则溶液显酸性,因此要使溶液显碱性,则酸的体积要小于盐溶液的体积,即①<②。
本题难度:一般
4、填空题 (3分)物质的量浓度均为0.1mol/L的下列溶液:①KNO3 、②Na2CO3 、③NaHCO3 、④NaHSO4 、⑤CH3COOH、⑥NaOH、⑦Ba(OH)2 ,pH由大到小的顺序为:?。?
参考答案:(3分)、⑦⑥②③①⑤④
本题解析:硝酸钾是强酸强碱盐,溶液显中性;碳酸钠是强碱弱酸盐,水解显碱性;碳酸氢钠溶液中水解程度大于电离程度,所以所以显碱性;硫酸氢钠是强酸的酸式盐,溶液显强酸性;醋酸是弱酸,溶液显酸性;氢氧化钠是强碱,溶液显碱性;氢氧化钡是二元强碱,溶液显碱性,所以pH由大到小的顺序为⑦⑥②③①⑤④。
点评:在判断溶液的酸碱性时应该准确判断电解质的强弱以及盐类是否水解等。
本题难度:简单
5、选择题 常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如下图。下列说法正确的是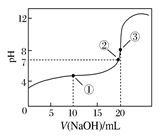
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
参考答案:C
本题解析:点①处醋酸过量。根据电荷守恒可知,c(CH3COO-)+c(OH-)=c(Na+)+c(H+),A不正确;点②所示溶液显中性,醋酸还是过量的,根据电荷守恒可知c(Na+)=c(CH3COO-),B不正确;当加入的氢氧化钠很少时,选项C中的关系是存在的,C正确;点③处而在恰好反应,溶质只有醋酸钠,应该是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),D不正确,答案选C。
点评:在判断酸碱中和过程中离子浓度变化以及离子浓度大小比较时,除了注意判断酸碱的用量外,最重要的是利用好几个守恒关系,即电荷守恒、物料守恒和质子守恒等,尤其是电荷守恒是经常用到的关系式,需要熟练掌握并能灵活运用。
本题难度:一般