时间:2019-06-25 22:50:04
1、填空题 (6分)25℃时,体积为Va、pH=α的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液混合后恰好完全反应。若Va>Vb,且α=0.4b,请填写下列空白:
(1)a可否等于2?(填“可”或“否”)__________。
(2)a可否等于4?(填“可”或“否”)__________。
(3)a的取值范围是_____________________。?
2、选择题 在不同温度下,水达到电离平衡时c(H+)与c(OH—)的关系如图4所示,下列说法中正确的是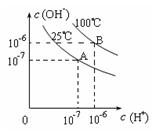
A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,所得溶液的pH等于7
B.25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl溶液等体积混合,所得溶液的pH等于7
C.25℃时, 0.2 mol/L NaOH溶液与0.2 mol/L乙酸溶液恰好中和,所得溶液的pH等于7
D.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH大于7
3、选择题 下列有关说法中正确的是(?)
A.HCO3—水解:HCO3—+H2O  CO32—+H3O+
CO32—+H3O+
B.中和滴定时眼睛必须注意锥形瓶内溶液颜色的变化
C.电解水生成H2和O2的实验中,可加入少量盐酸或硫酸增强导电性
D.用等浓度(0.5 mol·L-1)等体积(50 mL)的NaOH溶液与盐酸混合测定中和热
4、计算题 将5.13g Ba(OH)2粉末加入100 ml硫酸和盐酸的混合液中,充分反应至沉淀不再生成时,过滤得干燥沉淀5.825g。取滤液20ml跟足量铁粉反应,生成22.4ml(标准状况下)气体。求:
⑴滤液的pH
⑵原混合液中c(Clˉ)、c(SO42ˉ)。
5、选择题 下列热化学方程式能正确表示可燃物的标准燃烧热的是 ?
A.H2(g)+ 1/2O2(g)="=" H2O(g);△H=-242.0kJ/mol
B.CH4(g)+ 2O2(g)="=" CO2(g)+2H2O(l);△H=-802.3kJ
C.2H2(g)+ O2(g)="=" 2H2O(l);△H=-571.6kJ/mol
D.CO(g)+ 1/2O2(g)="=" CO2(g);△H=-283kJ/mol