时间:2019-06-25 22:36:51
1、实验题 (16分)
“白铁皮”即镀锌铁皮,镀锌层犹如铁皮的保护层,具有较强的耐腐蚀性,这层膜的厚度是判断白铁皮质量的重要指标,某研究性学习小组为了测定镀膜厚度,设计了下面的实验方案。
已知:
锌与强碱溶液反应的离子方程式为 :Zn+20H-=Zn022-+H2↑
锌的密度为dg/cm3
某学习小组同学设计了下图装置,使单侧面积为Scm2、质量为mg,的镀锌铁皮完全浸人6mol·L-1NaOH溶液中,充分反应。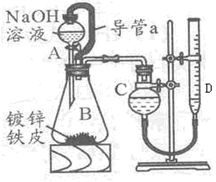
回答下列问题 :
(1)仪器名称A??_B??
(2)装置中导管 a 的作用是_________________________,
(3)干燥管C与量气管D?(具有刻度的细长玻璃管)在反应前后液面高度有何要求:
反应前_______________,反应后?,(答:“C中液面高于D中液面”,“C中液面低于D中液面”,“C中液面与D中液面相平”)其目的是_______________________。
(4)除了锌之外,另一种常见金属与强碱溶液反应的离子方程式为?。
(5)请设计实验证明,铁并未与强碱溶液反应而进入溶液?。
(6)实验前后量气管中液面读数分别为 V1mL、V2mL,(实验条件的气体摩尔体积为Vm L·mol-1), 则镀锌铁皮的厚度为h=_______________________cm(写出数学表达式)。
(7)请另设计一种测镀锌膜的厚度的方案,并用简单的方式表述出来:

2、实验题 (12分)实验室用如图所示的装置制取乙 酸乙酯.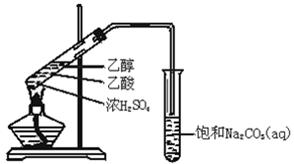
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是:?,然后轻轻振荡试管,使之混合均匀。
(2)装置中通蒸气的导管_________________________,目的是_______________。
(3)浓硫酸的作用是①___________;②___________.
(4)饱和Na2CO3溶液的作用是①________________________;②_____________________;
③_____________________________。
(5)生成的乙酸乙酯的化学方程式?。
(6)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物是_____________(填物质名称).
3、实验题 乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+?2Mn2++10CO2↑+8H2O
该组同学设计了滴定的方法测定x值。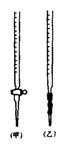
① 称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。
② 取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③ 用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL;
请回答:
⑴ 滴定时,将KMnO4标准液装在右图中的?(填“甲”或“乙”)滴定管中。
⑵ 本实验滴定达到终点的标志可以是?。
⑶ 通过上述数据,计算出x=?。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会?(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会?。
4、选择题 用下列气体和溶液进行喷泉实验,最终液体不能充满烧瓶的是
A.CO2和NaOH溶液
B.NH3和水
C.Cl2和NaOH溶液
D.NO2和水
5、实验题 I.某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验:
小组成员在做草酸溶液与酸性高锰酸钾溶液反应实验时发现,溶液褪色先慢后快。
(1)上述H2C2O4溶液与酸性KMnO4溶液反应的离子方程为?。
(2)为了探究此反应速率由小变大的原因,甲同学做了如下实验(表中“一”表示未加入该试剂)。
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸 溶液 | MnSO4固体 | 0.10 mol/L KMnO4溶液 | 褪色 时间 |
| 1 | 750C | 一 | 一 | 1mL | 100s |
| 2 | 750C | 10滴 | 一 | 1mL | 40s |
| 3 | 750C | 10滴 | 加入少许 | 1mL | 3s |