时间:2019-06-25 22:22:37
1、填空题 钢铁工业是国家工业的基础,请回答钢铁腐蚀、防护过程中的有关问题.
(1)若把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图1所示,能观察到酚酞变红的现象的区域是______(填I、II、III、IV),写出II处电极的电极反应式:______;写出IV处电极的电极反应式:______;写出该两种情况下发生的总反应的离子方程式:______;______.若把III的铁片改为碳棒,写出该处发生的电极反应式:______
(2)如图2所示各个装置中铁棒被腐蚀由易到难的顺序是______(填字母)
(3)利用如图3装置,可模拟铁的电化学防护,下列有关说法正确的是______(填字母)
A.若X为碳棒,为减缓铁的腐蚀,开关K应置于M处
B.若X为锌板,K置于M或N处,均能减缓铁的腐蚀
C.若X为碳棒,K置于M或N处,一段时间后溶液pH均不变
D.若X为碳棒,K置于M或N处,Cl-均向X电极移动
(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置如图4,请回答:
①B电极对应的金属是______(写元素名称),A电极的电极反应式是______
②若电镀前铁、铜两电极的质量相同,电镀完成后,若电镀时电路中通过的电子为0.2mol,将它们取出洗净、烘干、称量,则A、B两极质量相差______?g.
参考答案:(1)第一个装置是原电池,Zn为负极,溶液中的氧气在Ⅰ处得电子生成OH-,所以Ⅰ处变红;第二个装置是电解池,铁为阳极,溶液中的H+在Ⅳ处得电子,破坏了锌片附近水的电离平衡,使得OH-浓度增大,所以Ⅳ处变红,Ⅱ处是原电池的负极,电极反应为:Zn-2e-=Zn2+,Ⅳ处是电解池的阴极,发生电极反应为:2H++2e-=H2↑,该两种情况下发生的总反应的离子方程式:2Fe+O2+H2O=2Fe(OH)2、Fe+2H2O?通电?.?Fe(OH)2+H2↑,若把III的铁片改为碳棒,写出该处电极为惰性电极,发生的电极反应式:2Cl--2e-=Cl2↑,
故答案为:Ⅰ、Ⅳ;Zn-2e-=Zn2+;2H++2e-=H2↑;2Fe+O2+H2O=2Fe(OH)2;Fe+2H2O?通电?.?Fe(OH)2+H2↑;2Cl--2e-=Cl2↑;
(2)A、该装置中铁作负极,铁易失去电子而易被腐蚀;
B、该装置中铁作正极,铁电极上易得电子而被保护;
C、铁不发生电化学腐蚀;
D、铁作电解池的阴极而被保护;
同一种金属的腐蚀由快到慢的顺序是:电解池的阳极>原电池的负极>原电池正极>电解池阴极,所以铁棒被腐蚀由易到难的顺序ACBD,
故答案为:A>C>B>D;
(3)A、若X为锌棒,开关K置于M处,形成原电池,此时金属锌为负极,金属铁为正极,金属铁被保护,故A正确;
B、若X为锌棒,开关K置于M处,形成原电池,此时金属锌为负极,金属铁为正极,金属铁被保护,若X为锌板,K置于N处,形成原电池,此时金属锌为负极,金属铁为正极,金属铁被保护,故B正确;
C、若X为碳棒,K置于N处,形成电解池,金属铁为阴极,该极上氢离子得电子放出氢气,氢离子减少,阳极上是氯离子失电子产生氯气,导致溶液的pH增大,故C错误;
D、若X为碳棒,K置于M处形成原电池,氯离子移向负极金属铁,K置于N处,Cl-均向阳极碳棒电极移动,故D错误;
故选AB;
(4)①在铁件的表面镀铜的电镀池中,作阳极A的是镀层金属铜,Cu-2e-=Cu2+,阴极B是金属铁,故答案为:铁;Cu-2e-=Cu2+;
②电镀时两极反应为:A电极:Cu-2e-=Cu2+,B电极上:Cu2++2e-=Cu,若电镀时电路中通过的电子为0.2mol,则A极上质量减少6.4g,B极上质量增加6.4g,所以A、B两极质量相差12.8g,故答案为:12.8.
本题解析:
本题难度:一般
2、填空题 炒过菜的铁锅未及时洗净,在空气中不久便会因腐蚀而出现红褐色锈斑。请回答: ?
(1)铁锅的锈蚀是_______腐蚀(填“析氧"或“吸氧”?) ?
(2)写出铁锅腐蚀时负极的电极反应式______________
(3)写出铁锅在中性条件下正极的电极反应式_______________
参考答案:(1)吸氧?
(2)Fe-2e-==Fe2+?
(3)2H2O+O2+4e-==4OH-
本题解析:
本题难度:一般
3、填空题 防止钢铁的腐蚀是世界级难题,每年全世界钢产量的四分之一因腐蚀而损失,根据下图回答: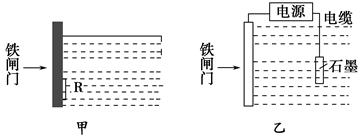
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为________________________。
(2)为降低某水库的铁闸门的被腐蚀速率,可以采用图甲方案,其中焊接在铁闸门上的固体材料R可以采用__________。
A.铜
B.钠
C.锌
D.石墨
(3)图乙所示方案也可降低铁闸门的被腐蚀速率,其中铁闸门应该连接在直流电源的________极。
参考答案:(1)负极:2Fe-4e-=2Fe2+?正极:O2+4e-+2H2O=4OH-
(2)C (3)负
本题解析:(1)发生吸氧腐蚀时,Fe为负极:Fe-2e-=Fe2+而腐蚀;正极上:O2+4e-+2H2O=4OH-。
(2)铁闸门上连接一块比铁更活泼的金属如锌就可由锌失去电子被腐蚀而把Fe保护起来。
(3)属外接电流的阴极保护法,需把被保护的物件(闸门)与电源的负极相连接。
本题难度:一般
4、选择题 下列有关化学反应现象和化学原理运用的叙述一定不正确的是( )
A.镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的
B.无机非金属材料光导纤维能够被氢氟酸腐蚀
C.石灰石高温煅烧能分解,与此反应是熵增反应有关
D.漂粉精的主要成分是Ca(ClO)2,Ca(ClO)2难分解,但漂粉精仍需密封保存
参考答案:A.锌比铁活泼,为原电池的负极,负极发生氧化反应,正极发生还原反应,为牺牲阳极的阴极保护法,故A正确;
B.光导纤维的主要成分为二氧化硅,能够被氢氟酸腐蚀,故B正确;
C.石灰石的分解为吸热反应,生成二氧化碳气体,△S增大,故C正确;
D.Ca(ClO)2难分解,但漂粉精仍需密封保存的原因是Ca(ClO)2生成易分解的HClO,故D错误.
故选D.
本题解析:
本题难度:一般
5、选择题 电化学原理在生活、生产中有非常广泛的应用,下列应用与电化学原理无关的是
A.“将光洁的工件加热至红热状,然后浸入水中”俗称烤蓝,是钢铁零件表面处理的一种防腐蚀工艺
B.远洋油轮船底镶嵌锌块
C.冶金工业冶炼某些活泼或较活泼金属
D.野外作业时,可用由铁屑、炭粒、食盐、水、空气组成的“热得快”来加热食品
参考答案:A
本题解析:略
本题难度:一般