时间:2019-06-25 22:22:37
1、选择题 下列说法正确的是?
A.向1mol/L氯化铁溶液中加入1mol/L氢氧化钠溶液可制得氢氧化铁胶体
B.0.1mol/L的氨水和氢氧化钠溶液分别稀释100倍后,氢氧化钠溶液的pH较氨水的大
C.用标准盐酸滴定未知浓度的氢氧化钠溶液,选用石蕊试液作指示剂
D.在铜、锌、稀硫酸构成的原电池中,阳离子向负极移动
参考答案:B
本题解析:
正确答案:B
A.不正确,(1)取1个小烧杯,加入25mL蒸馏水,将烧杯中的蒸馏水加热至沸腾。?(2)向沸水中逐滴加入5~6滴饱和氯化铁溶液。(3)继续煮沸至溶液呈红褐色,停止加热。可制得氢氧化铁胶体;B.正确, C.用标准盐酸滴定未知浓度的氢氧化钠溶液,选用石蕊试液作指示剂; D.不正确,在铜、锌、稀硫酸构成的原电池中,阳离子向正极移动。
本题难度:一般
2、填空题 生活中常常有这样的现象:一件普通的铁器,如不精心保管,便会生锈;若不引起注意,锈斑蔓延开来,就会吞噬整个铁器使之变成废物。人们称这种现象为“锈吃铁”。请用相关学科知识解释“锈吃铁”这一自然现象。
参考答案:首先是原电池的构成,铁器中铁作负极,其中杂质碳作正极,铁器表面的水膜构成电解液。?
(1)析氢腐蚀(负极):Fe-2e-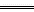 Fe2+,正极反应:2H++2e-
Fe2+,正极反应:2H++2e-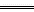 H2↑。析氢腐蚀后pH升高,从而发生吸氧腐蚀。?
H2↑。析氢腐蚀后pH升高,从而发生吸氧腐蚀。?
(2)吸氧腐蚀: Fe-2e-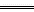 Fe2+,由于溶液中OH-浓度增大,生成Fe(OH)2,它很易被空气中的氧气所氧化:4Fe(OH)2+O2+2H2O
Fe2+,由于溶液中OH-浓度增大,生成Fe(OH)2,它很易被空气中的氧气所氧化:4Fe(OH)2+O2+2H2O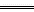 4Fe(OH)3,Fe(OH)3部分失水后生成海绵状物质Fe2O3·xH2O,它具有保湿作用,水膜的存在加速了铁器的腐蚀。
4Fe(OH)3,Fe(OH)3部分失水后生成海绵状物质Fe2O3·xH2O,它具有保湿作用,水膜的存在加速了铁器的腐蚀。
本题解析:铁在干燥的空气中不易生锈,但在潮湿的空气中发生了电化学腐蚀,腐蚀后生成的铁锈是一种海绵状的物质,具有保湿的作用,电解质水的存在促使铁器电化学腐蚀持续进行,直到铁器全部锈腐。?
本题难度:一般
3、选择题 下列关于金属的腐蚀说法正确的是( )
A.一般来说,金属发生化学腐蚀的速率比电化学腐蚀速率要快
B.保护地下钢管不受腐蚀,可使它连接直流电源的负极
C.钢铁发生析氢腐蚀时,正极的电极反应式为:2H2O+O2+4e-=4OH-
D.轮船底部放一块锌块,所采用的防腐方法为牺牲阴极的阳极保护法
参考答案:A、电化学中,原电池的负极和电解池的阳极金属腐蚀速率远远快于金属发生化学腐蚀的速率,故A错误;
B、当地下钢管连接直流电源的负极,则钢管是阴极,阴极在电解池中属于被保护的电极,故B正确;
C、钢铁发生析氢腐蚀时,正极是氢离子得电子的过程,即2H-+2e-=H2↑,故C错误;
D、轮船底部放一块锌块,形成锌、铁原电池,负极金属锌易被腐蚀,但是正极金属铁可以被保护起来,所采用的防腐方法为牺牲阳极的阴极保护法,故D错误.
故选B.
本题解析:
本题难度:简单
4、选择题 下图是研究金属腐蚀的实验。下列相关说法正确的是 
[? ]
A.食盐水中有气泡逸出
B.铁表面的反应为Fe-3e-=Fe3+
C.红色首先在食盐水滴的中心出现
D.该实验研究的是金属的吸氧腐蚀
参考答案:D
本题解析:
本题难度:简单
5、选择题 下列装置的线路接通后,经过一段时间,溶液的pH明显下降的是()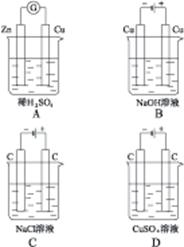
参考答案:D
本题解析:A为原电池,反应式为:Zn+H2SO4 ZnSO4+H2↑,c(H+)下降,pH上升。B、C、D均为电解池,反应式依次为:Cu+2H2O
ZnSO4+H2↑,c(H+)下降,pH上升。B、C、D均为电解池,反应式依次为:Cu+2H2O Cu(OH)2↓+H2↑、2NaCl+2H2O
Cu(OH)2↓+H2↑、2NaCl+2H2O 2NaOH+H2↑+Cl2↑、2CuSO4+2H2O
2NaOH+H2↑+Cl2↑、2CuSO4+2H2O 2Cu+2H2SO4+O2↑,则B中水减少,c(NaOH)上升、c(OH)-上升、pH上升;C中产生NaOH、pH上升;D中产生H2SO4,pH下降。故选择D选项。
2Cu+2H2SO4+O2↑,则B中水减少,c(NaOH)上升、c(OH)-上升、pH上升;C中产生NaOH、pH上升;D中产生H2SO4,pH下降。故选择D选项。
本题难度:简单