时间:2019-06-25 22:20:12
1、实验题 实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),其过程如下: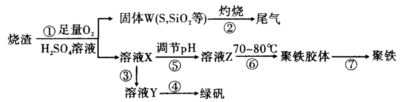
(1)过程①中,FeS和O2、H2SO4反应的化学方程式为?。
(2)过程②中产生的尾气会对大气造成污染,可选用下列试剂中的?吸收。
a.浓H2SO4? b.蒸馏水? c.NaOH溶液? d.浓硝酸
(3)过程③中,需要加入的物质名称是?
(4)过程④的实验操作是?
(5)过程⑥中,将溶液Z加热到70~80℃,目的是?。
(6)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取样品2.700 g;②将样品溶于足量盐酸后,加人足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495 g。若该聚铁主要成分为[Fe(OH)SO4]n,则该聚铁中铁元素的质量分数为?。
2、填空题 (13分)A是一种常见金属,各物质的转化关系如下图(反 应中其它产物未列出):
应中其它产物未列出):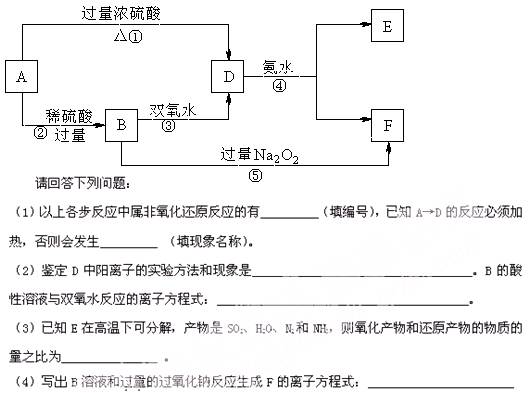
3、填空题 (11分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基础化工原料。铬常见价态有+3、+6价。铬的主要自然资源是铬铁矿FeCr2O4(含有Al2O3、MgO、SiO2等杂质),实验室模拟工业以铬铁矿为原料生产红矾钠的主要流程如下: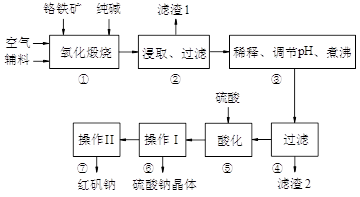
①中主要反应:4 FeCr2O4 + 8Na2CO3 + 7O2 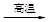 ?8Na2CrO4 + 2Fe2O3 + 8CO2
?8Na2CrO4 + 2Fe2O3 + 8CO2
①中副反应有多个如:Al2O3 + Na2CO3 2NaAlO2 + CO2↑等
2NaAlO2 + CO2↑等
请回答下列问题:
(1)FeCr2O4化学名为亚铬酸亚铁,写出它的氧化物形式________________。步骤“①”的反应器材质应选用__________(填“瓷质”、“铁质”或“石英质”)。请再写一个①中的副反应方程式?
(2)“②”中滤渣1的成分是____ 和____,“③”中调pH值是_______ (填“调高”或“调低”),“④”中?滤渣2的成分是H2SiO3、Al(OH)3 。
(3)若步骤2的溶液中加入过量的硫酸生成沉淀,则相关的离子方程式是:__________________________。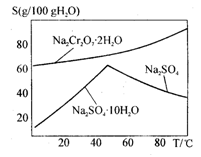
(4)上图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,则操作I是______,操作II 是______(填序号)。
是______(填序号)。
①蒸发浓缩,趁热过滤②降温结晶,过滤
4、填空题 为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理经处理后钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。主要反应如①②③:
① 3Fe+NaNO2+5NaOH = 3Na2FeO2+NH3+H2O
② ___Na2FeO2+____NaNO2+____H2O = ?N a2Fe2O4+?NH3+?NaOH
a2Fe2O4+?NH3+?NaOH
③ Na2FeO2+Na2Fe2O4+2H2O  ?Fe3O4+4NaOH
?Fe3O4+4NaOH
(1)配平化学方程式②。
(2)上述反应②中还原剂为?,被还原物质是? 。若有1mol Na2Fe2O4生成,则反应中有____________mol电子转移。
。若有1mol Na2Fe2O4生成,则反应中有____________mol电子转移。
(3)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是:?。
5、计算题 用黄铜矿炼铜按反应物和生成物可将总反应可以写成:
CuFeS2 + SiO2 + O2→ Cu + FeSiO3 + SO2
事实上冶炼反应是分步进行的。(1)黄铜矿在氧气作用下生成硫化亚铜和硫化亚铁;(2)硫化亚铁在氧气作用下生成氧化亚铁,并与二氧化硅反应生成矿渣;(3)硫化亚铜与氧气反应生成氧化亚铜;(4)硫化亚铜与氧化亚铜反应生成铜。
1)?写出上述各个分步反应(1,2,3,4)的化学方程式。
2)?给出总反应方程式的系数。
3)?据最新报道, 有一种叫Thibacillus ferroxidans的细菌在氧气存在下可以将黄铜矿氧化成硫酸盐。反应是在酸性溶液中发生的。试写出配平的化学方程式。
4)?最近我国学者发现,以精CuFeS2矿为原料在沸腾炉中和O2 (空气)反应, 生成物冷却后经溶解、除铁、结晶,得到CuSO4·5H2O,成本降低了许多。实验结果如下:
| 沸腾炉温度/℃ | 560 | 580 | 600 | 620 | 640 | 660 | |
| 生 成 物 | 水溶性Cu/% | 90.12 | 91.24 | 93.50 | 92.38 | 89.96 | 84.23 |
| 酸溶性Cu/% | 92.00 | 93.60 | 97.08 | 97.82 | 98.16 | 98.19 | |
| 酸溶性Fe/% | 8.56 | 6.72 | 3.46 | 2.78 | 2.37 | 2.28 | |