时间:2019-06-25 22:18:29
1、选择题 海水中含有丰富的锂资源,研究人员开发了一种只能让锂离子通过的特殊交换膜,并运用电解实现从海水中提取高浓度的锂盐,其工作原理如图所示。下列说法不正确的是
A.a 连接电源的正极
B.Li+ 的移动方向是从海水进入到盐酸中
C.过程中还可能获得有经济价值的副产物氢气和氯气
D.一段时间后,b电极附近溶液的pH降低
参考答案:D
本题解析:A. 根据题意要从海水中提取高浓度的锂盐,就要使海水中的Li+不断通过离子交换膜进入到左边的池中。根据同种电荷相互排斥,异种电荷相互吸引的原则,右边的电极b上应该负电荷较多,与电源的负极连接,则左边的a电极就要电源的正极连接,正确;在盐酸中含有的阳离子有H+, H+不断放电:2H++2e-=H2↑,为了维持平衡,Li+ 不断从海水进入到盐酸中,正确;C. 在过程中在a电极不断有Cl-放电产生Cl2,在b电极上,不断有H+放电产生H2,所以除了产生高浓度的锂盐,还可能获得有经济价值的副产物氢气和氯气,正确;D. 一段时间后,b电极附近溶液由于H+不断放电,c(H+)降低,所以附近溶液的pH升高,错误。
考点:考查电解原理的应用的知识。
本题难度:一般
2、填空题 (10分)图示的四个容器中分别盛有不同的溶液,除A、B外,其余电极均为石墨电极。甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4 2PbSO4+2H2O,其两个电极的电极材料分别是PbO2和Pb。
2PbSO4+2H2O,其两个电极的电极材料分别是PbO2和Pb。
闭合S,发现G电极附近的溶液变红,20 min后,将S断开,此时C、D两极上产生的气体体积相同;据此回答:
(1)A电极的电极材料是______________(填“PbO2”或“Pb”)。
(2)电解后,要使丙中溶液恢复到原来的浓度,需加入的物质是________(填化学式)。
(3)到20 min时,电路中通过电子的物质的量为________。
(4)0~20 min,H电极上发生反应的电极反应式为______________
参考答案:28(1)PbO2 (2) H2O (3)0.4mol; (4)2Cl--2e-=Cl2↑;4OH--4e-=O2+2H2O
本题解析:(1)闭合S,发现G电极附近的溶液变红,说明G的电极反应为2H2O+2e-=H2+2OH-,G为阴极,则H为阳极,A为正极,A电极的电极材料是PbO2;(2)丙中电解硫酸铝溶液,实际上是电解水,要使丙中溶液恢复到原来的浓度,需加入的物质是水;(3)20 min后,将S断开,此时C、D两极上产生的气体体积相同,设C、D产生气体的物质的量为xmol,
C极发生的电极反应为Cu2+ + 2e- =" Cu" 、2H+ + 2e- = H2↑,D极的电极反应为4OH— - 4e- = 2H2O + O2↑
0.1 0.2 2x x 4x x
0.2+2x="4x" 解得x="0.1" 则到20 min时,电路中通过电子的物质的量为0.4mol;
(4)0~20 min,H电极上发生反应的电极反应式为2Cl--2e-=Cl2↑;0.2moLCl-只放电0.2moL,随后是OH-放电,即4OH--4e-=O2+2H2O 。
考点:考查铅蓄电池,电解原理的应用。
本题难度:一般
3、选择题 如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16 g,乙池中某电极上析出0.64 g某金属,下列说法正确的是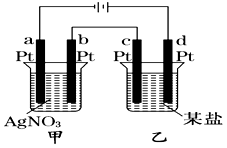
A.甲池b极上析出金属银,乙池c极上析出某金属
B.甲池a极上析出金属银,乙池d极上析出某金属
C.某盐溶液可能是CuSO4溶液
D.某盐溶液可能是Mg(NO3)2溶液
参考答案:C
本题解析:a、c为阴极,b、d为阳极,金属阳离子移向阴极发生还原反应析出金属单质,则甲池a极上析出金属银,乙池c极上析出某金属,故A和B均错误;Ag++e—=Ag,n(Ag)=2.16g÷108g?mol—1=0.02mol,根据系数之比等于物质的量之比,则转移电子也为0.02mol,而Mn++ne—=M,根据电子守恒,则n×0.64g÷M(M)=0.02mol,M(M)="32n" g?mol—1,n=1时不成立,n=2时M为Cu,故C正确;阴极放电能力:Mg2+<H+,则某盐溶液不可能是Mg(NO3)2溶液,故D错误。
本题难度:简单
4、填空题 某化学兴趣小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜(含有少量的锌、铁、银、金等金属和少量矿物杂质)的提纯,并对阳极泥和电解液中金属进行回收和含量测定。请回答以下问题。
(1)电解时,粗铜应与电源的 极相连,阴极上的电极反应式为 ;电解过程中,硫酸铜的浓度会 (选填“变大”“不变”或“变小”)。
(2)电解完成后,该小组同学将电解液过滤后对滤液和阳极泥分别进行处理:
①阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
②Cu的回收、滤液成分及含量的测定:以下是该小组设计的一个实验流程。
在上述流程中空格内填上相应的操作: 、 ;100 mL滤液中Cu2+的浓度为 mol/l,Fe2+的浓度为 mol/l。
参考答案:(1)正 Cu2++2e-=Cu 变小 (2) ① 3Ag+4H++NO3-=3Ag++NO+2H2O ② 过滤 洗涤 0.5 0.1
本题解析:(1)电解时,粗铜应与电源的正极极相连,作阳极;阴极上铜离子得到电子,电极反应式为Cu2++2e-=Cu;由于阳极粗铜中还有活泼的金属失去电子,而阴极上始终是溶液中的铜离子放电,因此电解过程中,硫酸铜的浓度会变小;
(2)①金属银可以和稀硝酸反应生成硝酸银、一氧化氮和水,即3Ag+4H++NO3-=3Ag++NO↑+2H2O;
②100mL的滤液中含有亚铁离子、铜离子、锌离子,当加入足量的金属Fe以后,会将金属铜全部置换出来,所得固体是铁与铜的混合物。酸浸后铁溶解,要得到金属铜,需要进行的操作是过滤、洗涤、干燥、称量,所以生成的3.2g金属是Cu,物质的量是3.2g÷64g/mol=0.05mol,所以铜离子的浓度c=0.05mol÷0.1L=0.5 mol/L;亚铁离子和氢氧化钠反应生成氢氧化亚铁,在空气中更易被氧化为氢氧化铁,受热分解生成的氧化铁的质量是4.8g,物质的量是4.8g÷160g/mol=0.03mol。根据原子守恒,亚铁离子的物质的量是:0.03mol×2=0.06mol。其中与铜离子反应的铁的物质的量是0.05mol,生成亚铁离子的物质的量是0.05mol,所以原溶液中亚铁离子的物质的量是0.06mol-0.05mol=0.01mol,浓度c=0.01mol÷0.1L=0.1mol/L。
考点:考查电解精炼铜以及物质的含量测定的实验方案设计
本题难度:一般
5、计算题 如下图所示,若电解5 min,铜电极质量增加2.16 g。试回答: ?
?
(1)电极X是电源的?极。
(2) pH变化:A?,B?,C?。
(3)若A中KCl溶液的体积为200 mL,电解至5 min,溶液的pH是?(假设溶液体积不变化)。
参考答案:(1)负? (2)增大减小不变? (3) 13
本题解析:(1)由铜电极质量增加可知铜电极为阴极,进一步可推知X是电源的负极。(2)A电解的方程式为2KCl+2H2O H2↑+Cl2↑+2KOH,A溶液pH增大;B电解的方程式为2CuSO4+2H2O
H2↑+Cl2↑+2KOH,A溶液pH增大;B电解的方程式为2CuSO4+2H2O 2Cu+O2↑+2H2SO4,B溶液pH减小;C是电镀池,C溶液pH不变。(3)根据电子得失守恒得如下关系式:2KCl+2H2O
2Cu+O2↑+2H2SO4,B溶液pH减小;C是电镀池,C溶液pH不变。(3)根据电子得失守恒得如下关系式:2KCl+2H2O H2↑+Cl2↑+2KOH~2e-~2Ag,由铜极上析出Ag的质量可计算出A中生成的KOH的物质的量,进而即可计算出A溶液的pH。
H2↑+Cl2↑+2KOH~2e-~2Ag,由铜极上析出Ag的质量可计算出A中生成的KOH的物质的量,进而即可计算出A溶液的pH。
本题难度:简单