时间:2019-06-25 22:17:06
1、选择题 下列有关金属晶体的说法中正确的是( )
A.常温下都是晶体
B.最外层电子数少于3个的都是金属
C.任何状态下都有延展性
D.都能导电、传热
参考答案:D
本题解析:Hg常温下是液态,不是晶体,A项错误。H、He最外层电子数都少于3个,但它们不是金属,B项错误。金属的延展性指的是能抽成细丝、轧成薄片的性质,在液态时,由于金属具有流动性,不具备延展性,所以C项也是错误的。金属晶体中存在自由电子,能够导电、传热,因此D项是正确的。
本题难度:简单
2、选择题 在金刚石的晶体中,含有由共价键形成的碳原子环,其中最小的环上所需碳原子数及每个碳原子上任意两个C--C键间的夹角是(? )
A.6个120°
B.5个108°
C.4个109°28′
D.6个109°28′
参考答案:D
本题解析:根据金刚石的晶体结构特点可知,最小的环上有6个碳原子。由于每个碳原子都是形成个相同的共价键,所以基本构型是正四面体,键角是109°28′,答案选D。
点评:该题是基础性试题的考查,主要是考查学生对教材中金刚石晶体结构的熟悉了解程度,意在调动学生的学习兴趣,激发学生的学习积极性和学习效率。本题难度不大,记住即可。
本题难度:简单
3、计算题 (1)中学化学教材中图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与
NaCl相同,Ni2+与最临近O2-的核间距离为a×10-8 cm。计算NiO晶体的密度(已知NiO 的摩尔质量为74. 7g/mol)。
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图所示的缺陷: 一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子个数之比。 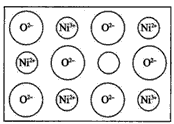
参考答案:(1) 
(2)6:91
本题解析:
本题难度:一般
4、选择题 下列各组中,含的离子晶体、分子晶体、原子晶体各一种的是(?)
A.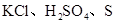 ?B. 金刚石、
?B. 金刚石、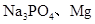
C. HF、SiC、Ar?D. 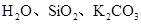
参考答案:D
本题解析:A.KCl是离子晶体,而H2SO4、S单质都是分子晶体。错误。B. 金刚石是原子晶体;Na3PO4是离子晶体,Mg是金属晶体。错误。C. HF、Ar都是分子晶体,而 SiC是原子晶体。错误。D. H2O是分子晶体;SiO2是原子晶体;K2CO3是离子晶体.符合题意。正确。
本题难度:一般
5、填空题 (1)+3价Co的配合物CoClm·nNH3,中心原子的配位数为6,若1 mol该配合物与足量AgNO3溶液反应生成1 mol AgCl沉淀,用配合物形式写出该配合物的化学式?。
(2)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大磁记录性能越好。离子型氧化物MnO2和Fe3O4及Cr2O3中,磁性最大的是___________。
(3)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨(如下左图),每个碳原子通过 ? 杂化与周围碳原子成键。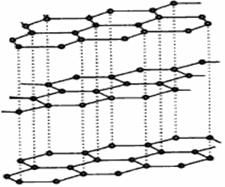 ?
? ?
?
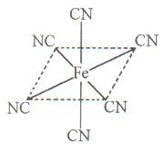
(4)铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如上右图。
①已知CN—与N2结构相似,1molCN-中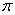 键数目为?。
键数目为?。
②上述沉淀溶解过程的化学方程式为?。
参考答案:(10分)(1)[CoCl2(NH3)4]Cl(2)Fe3O4(3)sp2?(4)①2NA
② 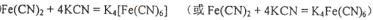 ?(各2分)
?(各2分)
本题解析:(1)1 mol该配合物与足量AgNO3溶液反应生成1 mol AgCl沉淀,这说明该配位化合物中有1个氯离子不是配体。又因为Cr是+3价的,则氯原子的购书是3个,由于配位数是6,所以化学式应该是[CoCl2(NH3)4]Cl。
(2)根据核外电子排布式可知,离子型氧化物MnO2和Fe3O4及Cr2O3中金属阳离子含有的未成对电子分别是3、14/3、3,所以磁性最大的Fe3O4。
(3)石墨是层状结构,所以每个碳原子通过sp2杂化与周围碳原子成键。
①CN—与N2结构相似,氮气中含有三键,有2个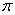 键,所以1molCN-中
键,所以1molCN-中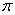 键数目为2NA。
键数目为2NA。
②根据结构式可知,分子中含有配位健,且配位数是6,所以沉淀溶解过程的化学方程式为Fe(CN)2+4KCN=K4Fe(CN)6。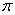 键的判断和有关计算
键的判断和有关计算
点评:该题是高考中的常见题型和考点,属于中等难度试题的考查。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力和方法的培养与训练,有利于培养学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力,旨在考查学生对知识的掌握与利用。
本题难度:一般