时间:2019-06-25 21:59:26
1、选择题 四种短周期元素在周期表中的相对位置如下图所示,其中W的最外层电子数与质子数之比为3:8.下列叙述不正确的是( )
A.Z与X、Y均能形成原子晶体
B.X与W形成的化合物分子是非极性分子
C.四种元素的气态氢化物中,W的气态氢化物相对分子质量最大,熔沸点最高
D.X、Z、W三种元素对应的最高价含氧酸中,Z的含氧酸酸性最弱
2、选择题 短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期.X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1.下列比较正确的是( )
A.元素非金属性:Z>Y>X
B.最高价氧化物水化物酸性:Z>Y
C.原子半径:Z<Y<X
D.气态氢化物的稳定性:Z<Y<X
3、选择题 一种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图所示,其中圆圈表示钛原子,黑点表示碳原子,则它的化学式为(?)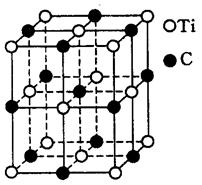
A.TiC
B.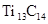
C.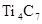
D.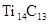
4、选择题 不锈钢的种类很多,其中一种铁元素以外,还含有较多的Cr(铬)、Ni(镍)、Mo(钼),少量的Si(硅)、C(碳),微量的S(硫)、P(磷)。
(1)上述元素中属于第三周期且第一电离能从大到小排列的是_______
(2)Mo(钼)处于第五周期,且与Cr(铬)元素位于同一族,则基态Mo(钼)原子的外围电子(价电子)排布式是_______。
(3)CH4的沸点比SiH4低,原因是_______。
(4)镍元素能形成多种配合物,配离子[Ni(CN)4]2—中不含有的是____(填选项编号)。
A.离子键
B.配位键
C.σ键
D.π键E.氢键
(5)碳元素有多种单质,其中C60分子有独特的球形结构:C60分子中原子轨道杂化类型是_______。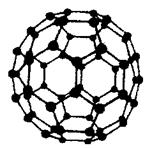
(6)碳的另一种单质石墨呈层状结构,有一碳镁新型材料就是在石墨碳原子层间加人镁原子层,两层俯视图: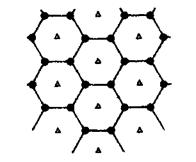
该材料的化学式为_______。
5、选择题 判断下列有关化学基本概念的依据正确的是
[? ]
A.溶液与胶体本质的不同是能否发生丁达尔效应
B.共价化合物:是否含有共价键
C.强、弱电解质:溶液的导电能力大小
D.氧化还原反应:元素化合价是否变化