时间:2019-06-25 21:59:26
1、填空题 有以下物质:①HF ②Cl2 ③H2O ④N2 ⑤C2H4 ⑥C2H6 ⑦H2 ⑧H2O2 ⑨HCN(H-C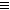 N)。
N)。
只有σ键的是_______;既有σ键,又有π键的是_______;含有由两个原子的s轨道重叠形成的σ键的是_______;含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是______;含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是___________;
参考答案:①②③⑥⑦⑧;④⑤⑨;⑦;①③⑤⑥⑧⑨;②④⑤⑥⑧⑨
本题解析:
本题难度:一般
2、选择题 图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是( )
A.非金属性:Y>Z>M
B.离子半径:M->Z2->Y-
C.三种元素中,Y的最高价氧化物对应的水化物酸性最强
D.ZM2分子中各原子的最外层均满足8电子稳定结构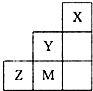
参考答案:由X、Y、Z、M在短周期的相对位置可知,X为氦元素、Y为氟元素、Z为硫元素、M为氯元素.
A、同周期随原子序数增大非金属性增强,非金属性M>Z,同主族自上而下非金属性减弱,非金属性Y>M,所以非金属性Y>M>Z,故A错误;
B、电子排布相同,核电荷数越大离子半径越小,所以离子半径S2->Cl-,最外层电子数相同,电子层越大离子半径越大,所以离子半径,Cl->F-,故离子半径径S2->Cl->F-,故B错误;
C、氟元素没有正化合价,Cl的最高价氧化物对应的水化物酸性最强,故C错误;
D、SCl2分子中氯原子与硫原子之间形成1对共用电子对,硫原子呈2个S-Cl键,分子中各原子的最外层均满足8电子稳定结构,故D正确.
故选:D.
本题解析:
本题难度:简单
3、填空题 (11分)A、B、C、D、E、F六种短周期元素的原子序数依次增大。A是宇宙中含量最丰元素,B元素的原子价电子排布为nsnnpn,D元素的最外层电子数是其电子层数的3倍,F的最高价氧化物对应水化物有两性,能溶于C、E的最高价氧化物对应水化物中。试回答
(1)写出C原子的价层电子轨道表示式: ;D原子的价层电子排布式:___________,E的原子结构示意图:___________;
(2)B位于元素周期表的第?族,A、B形成原子个数比1:1且直线形分子的结构式: ;
(3)C的基态原子核外有 种不同运动状态的电子;
(4)E单质在空气中燃烧生成物的电子式: ,其中的阳离子与阴离子的个数比是 ;
(5)F的固态氧化物的用途有________ ___(说出一种)。F的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是? ?。
参考答案:(11分,除最后一空2分,其余每空1分)
⑴N: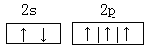 、O:2s22p4、Na:
、O:2s22p4、Na:
⑵ IVA、H-C≡C-H;
⑶7;⑷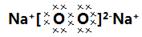 、2:1;
、2:1;
⑸耐火材料(砖),人造刚玉,冶炼铝等、4Al+3TiO2+3C 2Al2O3+3TiC
2Al2O3+3TiC
本题解析:根据元素的性质及结构可知,A、B、C、D、E、F六种短周期元素分别是H、C、N、O、Na、Al。
(1)根据构造原理可知,氮原子的价层电子轨道表示式为 。氧原子的价电子的电子排布式为2s22p4。钠原子的结构示意图为
。氧原子的价电子的电子排布式为2s22p4。钠原子的结构示意图为 。
。
(2)碳元素位于第 IVA,A、B形成原子个数比1:1且直线形分子是乙炔,结构式为H-C≡C-H。
(3)氮原子核外有7个电子,就有7种不同运动状态的电子。
(4)钠燃烧生成过氧化钠,电子式为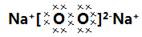 ,其中的阳离子与阴离子的个数比2︰1。
,其中的阳离子与阴离子的个数比2︰1。
(5)氧化铝的熔点高,钠作耐火材料(砖),人造刚玉,也能冶炼铝等。根据原子守恒可知,方程式为4Al+3TiO2+3C 2Al2O3+3TiC。
2Al2O3+3TiC。
本题难度:一般
4、选择题 有关乙炔分子中的化学键描述不正确的是
[? ]
A.两个碳原子采用sp杂化方式
B.两个碳原子采用sp2杂化方式
C.每个碳原子都有两个未杂化的2p轨道形成π键
D.两个碳原子形成两个π键
参考答案:B
本题解析:
本题难度:一般
5、选择题 已知115号元素原子有七个电子层,且最外层有5个电子,试判断115号元素在元素周期表中的位置是( )
A.第七周期第IIIA族
B.第七周期第VA族
C.第五周期第VIIA族
D.第五周期第IIIA族
参考答案:B
本题解析:
本题难度:一般