时间:2019-06-25 21:52:32
1、实验题 (2014届四川省泸州市高三第一次诊断性考试化学试卷)
在高温时硫铁矿(主要成分FeS2)和氧气反应生成三氧化二铁和二氧化硫(假设硫铁矿中的杂质不参与化学反应)。某化学研究学习小组对硫铁矿样品进行如下实验探究:
【实验一】测定硫元素的含量
I.实验装置如下图所示(夹持和加热装置已省略)。A中的试剂是双氧水,将m·g该硫铁矿样品放人硬质玻璃管D中。从A向B中逐滴滴加液体,使气体发生装置不断地缓缓产生气体,高温灼烧硬质玻璃管D中的硫铁矿样品至反应完全。
II.反应结束后,将E瓶中的溶液进行如下处理:
【实验二】测定铁元素的含量
III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解已冷却的硬质玻璃管D中的固体,过滤,得到滤液A;
②在滤液A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
③将滤液B稀释为250 mL;
④取稀释液25.00 mL,用浓度为c mol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体
积的平均值为V mL。
请根据以上实验,回答下列问题:
(1)I中装置C中盛装的试剂是_?;E瓶的作用是_?。
(2)11中加入过量H2O2溶液发生反应的离子方程式为____。
(3)111的步骤③中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,
还必须要用到的是_?;④中盛装KMnO3溶液的仪器是_?。
(4)假设在整个实验过程中硫元素和铁元素都没有损失,则该硫铁矿样品中硫元素的质量分数为_?。(用含m1和m2的代数式表示);铁元素的质量分数为____。(用含m1、c、v的代数式表示)
参考答案:(14分)(1)浓硫酸(1分);吸收二氧化硫(2分)(2)H2O2+SO32-=SO42-+H2O(3分)
(3)250ml容量瓶(2分);酸式滴定管(2分)
(4) ×100%(2分);
×100%(2分); ×100%(2分)
×100%(2分)
本题解析:
(1)A中盛有双氧水,说明该装置是制备氧气的。由于氧气中含有水蒸气,所以C中盛装的试剂是浓硫酸,用来干燥氧气;硫铁矿样品和氧气在高温下反应生成SO2,所以E中氢氧化钠溶液的作用是吸收二氧化硫。
(2)氢氧化钠溶液吸收二氧化硫生成亚硫酸钠,所以11中加入过量H2O2的目的是氧化亚硫酸钠,生成硫酸钠。因此溶液中发生反应的离子方程式为H2O2+SO32-=SO42-+H2O.
(3)111的步骤③中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,
还必须要用到的是250mL容量瓶;④中取稀释液25.00ml,溶液是酸性溶液,体积数据要求到小数点后两位,需用的仪器是酸式滴定管,所以④中盛装KMnO3溶液的仪器是酸式滴定管。
(4)最终所得沉淀是硫酸钡,根据硫原子守恒得硫的质量,设硫的质量为x,则
S——BaSO4
32g? 233g
x?m2g
解得x= g
g
所以质量分数= ×100%
×100%
高锰酸钾的还原产物是Mn2+,在反应中得到7-2=5个电子。而Fe2+在反应中失去1个电子,所以根据电子的得失守恒可知,在25.00ml溶液中亚铁离子的物质的量是cmol/L×0.001VL×5=0.005cVmol,所以铁元素的质量分数= ×100%=
×100%= ×100%
×100%
本题难度:一般
2、实验题 (10分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe与水蒸气反应的实验"。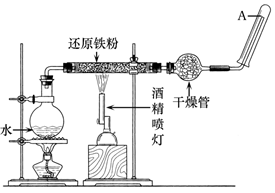
请回答该实验中的问题。
(1)写出该反应的化学方程式?。
(2)实验前必须对整套装置进行的操作是?。
(3)硬质玻璃管中石棉绒的主要作用是?。
(4)干燥管中盛装的物质可以是?
(5)点燃酒精灯和酒精喷灯的先后顺序是?
参考答案:(1) 3Fe + 4H2O(g)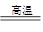 Fe3O4 + 4H2
Fe3O4 + 4H2
(2) 检查气密性
(3) 增大铁与水蒸气的接触面积
(4) 碱石灰
(5) 先点燃酒精灯再点燃酒精喷灯
本题解析:考查铁与水蒸气的反应
水蒸气由烧瓶中的水、酒精灯加热所得,同时为了增大反应物的接触面积,在横质玻璃管中盛装石棉绒
为了防止铁粉的氧化,同时为了防止高温下氢气的爆炸,故在反应开始时,应当先点酒精灯,这样能够先产生水蒸气排尽玻璃管内的空气,而实验结束时,应该先熄灭酒精喷灯;
本题难度:一般
3、实验题 (15分)化学世界奥妙无穷,物质之间的反应更是神秘莫测,善于透过现象看本质是学习化学、研究物质性质的基本能力。请我们一起进行探索。
(1)课堂上化学老师将干燥的氯气依次通过干燥红布条和潮湿的红布条,结果:干燥红布条无明显变化,而潮湿的红布条褪色。
①某学生立即发言:结论一、?,
结论二、氯气与水反应生成的次氯酸具有漂白性。
②老师提示说:还需要补充一个实验才能得知结论二,该实验是?
③请写出氯气与水反应的离子方程式?
(2)某实验小组用铜和浓硝酸反应制备NO2,并收集一试管NO2气体,将集气瓶倒置于水槽中,并轻微振荡,发现一些典型现象,并对此现象进行探究。
①请写出NO2与水反应化学方程式,并用单线桥表示电子转移方向和数目
?
②该小组成员积极探讨,得出结论,NO2与水一定发生了化学反应,并设计了两个实验操作对产物进行了验证,得出产物是NO 和HNO3。请填写下表中的甲、乙、丙三处。
| 实验操作 | 实验现象 | 实验结论 | |||||||||
| 用玻璃片将水槽中的试管口盖住,轻轻将试管取出 | 试管内约有2/3体积的水溶液,且无色 | NO2与水发生了化学反应,而不是溶于水 | |||||||||
| 将试管正立,取下玻璃片 | 甲 | NO2和水反应生成了NO气体 | |||||||||
| 乙 | 丙 | NO2和水反应生成了硝酸 参考答案: 本题解析:略 本题难度:简单 4、填空题 某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S,设计了以下实验流程图: 参考答案: 本题解析:略 本题难度:一般 5、实验题 为了研究外界条件对H2O2分解速率的影响,某同学做了以下实验,请回答下列问题。
(2)实验①的目的是________。 (3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是_______(用实验中所提供的几种试剂)。 (4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最快的是______(填“A”或“B”或“C”)。 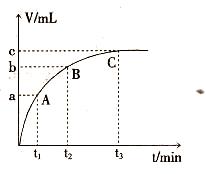 ? ?(5)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题: 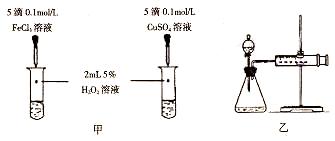 ①定性分析:如图甲可通过观察_________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______。 ②定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是_________。 参考答案: 本题解析:考查外界条件对反应速率的影响。 本题难度:简单 |