时间:2019-06-25 21:52:32
1、实验题 (6分)下图是某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器.铁架台.试管夹均未画出)。图中A处为无水乙醇(沸点78℃),B处为绕成螺旋状的细铜丝,C处为无水CuSO4粉末,D处为碱石灰,F处为新制的碱性Cu(OH)2悬浊液。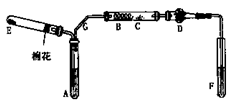
(1)在上述装置中,实验需要加热的仪器按加热的先后顺序排列为(填序号)?。
(2)为使A中乙醇平稳地汽化成乙醇蒸气,常用的方法是?。
(3)写出B处的现象?。
参考答案:(6分)(1)B.E.A.F。(2)将试管A放入78℃的热水浴中。(3)铜丝的表面红色与黑色交替出现
本题解析:乙醇催化氧化的实验原理:2CH3CH2OH+O2Cu/Ag△2CH3CHO+2H2O;所以
(1)加热的仪器先后顺序为:B、E、A、F,实验时应先加热铜丝使温度升高,再通入氧气生成氧化铜,再加热A产生乙醇蒸气;
(2)由于无水乙醇和沸点78℃比水低,为产生平稳的气流,常用水浴加热的方法加热。
(3)铜丝表面现象将会出现红、黑交替现象。其实质铜做为催化剂作用。
本题难度:简单
2、选择题 (1)如下图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是________________。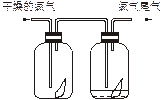
(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用_____________溶液吸收多余的氯气,原理是(用化学方程式表示)__________________________。
根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是___________(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是___________(用字母代号填)。
A.O2? B.Cl2? C.CO2? D.HClO
(3)据“北方网”报道,2004年4月15日至16日,位于重庆市江北区的天原化工总厂相继发生氯气泄漏和爆炸事故。截至记者发稿时,已有9人在事故中失踪死亡,3人受伤,15万人被紧急疏散。当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是_______。
A.NaOH? B.NaCl? C.KBr? D.Na2CO3
参考答案:(1)潮湿的有色布条褪色而干燥有色布条不褪色?(2)氢氧化钠(NaOH)? 2NaOH+Cl2====NaClO+NaCl+H2O? Ca(ClO)2? C?(3)D
本题解析:略
本题难度:一般
3、填空题 (12分)不同的金属在化学反应中表现出来的活泼程度不同,俄国化学家贝开托夫在大量实验和系统研究之后,于1865年发表了金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 。
(1)金属活动性顺序是学习“金属及其化合物”的重要工具,许多“金属及其化合物”的知识规律可以通过金属活动性顺序来掌握。例如,工业上冶炼金属,根据金属 活动性顺序可以采用不同的冶炼方法。其中可以用“热分解法”冶炼的金属是__________、?。
活动性顺序可以采用不同的冶炼方法。其中可以用“热分解法”冶炼的金属是__________、?。
工业上又常用下列反应进行金属钾的冶炼: ,似乎“违背”了金属活动性顺序,试解释钠能将更活泼的钾置换出来的原因__________________________ 。
,似乎“违背”了金属活动性顺序,试解释钠能将更活泼的钾置换出来的原因__________________________ 。
(2)在实践中发现还有许多化学事实 “违背”金属活动性顺序,但这些“反常”现象都可以通过化学原理得到合理解释。某学生在做探究实验时,把锌粒投入1mol·L-1氯化铁溶液中,观察到如下实验现象:锌粒表面有一定 量气泡产生,溶液颜色逐渐变浅,一段时间后溶液
量气泡产生,溶液颜色逐渐变浅,一段时间后溶液 逐渐浑浊,试用相关反应方程式进行解释_________________________________、
逐渐浑浊,试用相关反应方程式进行解释_________________________________、
__________________________________________________________________________。
(3)研究金属活动性顺序还可以指导对金属阳离子氧化性强弱的认识,工业上用氯化铁溶液腐蚀铜制电路板。
①请根据金属活动性顺序结合该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性强弱?。
②请运用原电 池原理设计实验 91exam.org验证Cu2+、Fe3+氧化性强弱的结论。
池原理设计实验 91exam.org验证Cu2+、Fe3+氧化性强弱的结论。
方案___________________________ ___________________________________________。
___________________________________________。
参考答案:(1)Hg、Ag?该反应为可逆反应,及时抽出钾蒸气,导致平衡不断正向移动。
(2)Zn+2Fe3+=Zn2++2Fe2+
3Zn+2Fe3++6H2O 2Fe(OH)3↓+3H2↑+3Zn2+
2Fe(OH)3↓+3H2↑+3Zn2+
说明:若写出:Fe3++3H2O Fe(OH)3+3H+,Zn+2H+=Zn2++H2↑给2分。若只写出Fe3++3H2
Fe(OH)3+3H+,Zn+2H+=Zn2++H2↑给2分。若只写出Fe3++3H2 O
O Fe(OH)3+3H+给1分。写化学方程式也可以。
Fe(OH)3+3H+给1分。写化学方程式也可以。
(3)①Fe3+>Cu2+>Fe2+
②方案:将铜棒与碳棒用导线连接,再插入氯化铁溶液,发现有电流产生
本题解析:略
本题难度:简单
4、填空题 某校兴趣小组对氢氧化钠溶液和稀盐酸混合后的有关问题,进行了如下探究:
Ⅰ.(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发 生反应,设计并完成了如图所示
生反应,设计并完成了如图所示
实验。?
X溶液是?,滴入的量一般为?。
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有氢氧化钠溶液的 试管中,用胶头滴管慢慢滴入稀盐酸,不断振荡溶液,同时测定溶液的pH,直至盐酸过量。
试管中,用胶头滴管慢慢滴入稀盐酸,不断振荡溶液,同时测定溶液的pH,直至盐酸过量。
①写出测定溶液pH的方法:?。
②上图中哪个图像符合该同学的记录?(填序号)。
(3)你认为甲、乙两位同学的实验中,?(填“甲同学”、“乙同学”或“甲、乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由:?。
Ⅱ.丙同学测出10mL 10%的NaOH溶液和不同体积的10%的盐酸溶液混合过程中,溶液的温度变化见下表(假设两溶液密度相同)。
| 加入盐酸的 体积(  )/mL )/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
| 溶液温度上升 | 5.2 | 9.6 | 12.0 | 16.0 | 18.2 | 16.7 | 15.7 | 14.7 | 13.7 |
 度上升与加入盐酸体积之间的变化关系图,并在曲线上画出能表示两者之间恰好完全反应的点,并用字母P表示。
度上升与加入盐酸体积之间的变化关系图,并在曲线上画出能表示两者之间恰好完全反应的点,并用字母P表示。 ?
?
参考答案:Ⅰ.(1)酚酞,1~2滴;(2)①用干净的玻璃棒蘸取待测液滴到pH试纸上,半分钟后,将试纸的颜色与标准比色卡对照,读出溶液的pH即可。
②C?(3)乙同学。甲同学的实验不能充分说明盐酸的氢氧化钠发生了反应,有可能是盐酸和红色物质反应生成了无色物质。乙同学的实验,随着滴加盐酸,溶液的pH由大于7逐渐减少到7,这充分证明溶液中的氢氧化钠因反应而消耗了;
Ⅱ.(1)放热反应;(2)曲线见下图;Ⅲ.(1)29.2%;(2)盐酸具有挥发性。
本题解析:略
本题难度:一般
5、实验题 某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。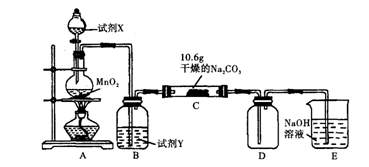
(1)写出装置A中发生反应的化学方程式:?。
(2)写出试剂Y的名称:?。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和?;
假设2:存在三种成分:NaHCO3和?、?。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。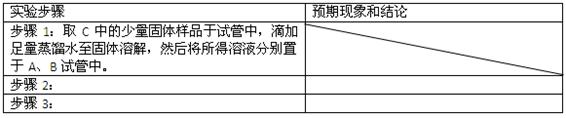
(4)已知C中有0.1mol Cl2参加反应。若假设l成立,可推知C中反应的化学方程式为? ?。
?。
参考答案:(1)4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O(2分)
MnCl2+Cl2↑+2H2O(2分)
(2)饱和食盐水(或饱和氯化钠溶液)(1分)
(3) 假设一:存在NaHCO3和NaCl(2分)
假设二:存在NaHCO3和NaCl、 Na2CO3、(2分)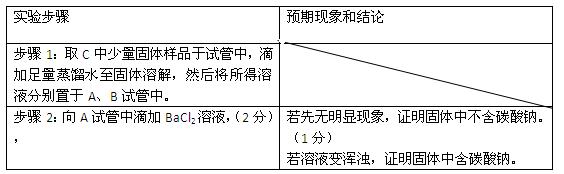
(4)2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O↑(3分)
本题解析:本题主要强化教材实验室制备氯气的知识点。先制备氯气,看到MnO2,可以确定试剂为浓盐酸,试剂Y饱和食盐水(或饱和氯化钠溶液)。根据反应物Cl2、Na2CO3、H2O,从组成的角度来看,可能有NaHCO3、NaCl、NaClO、NaClO3等可能,确定的是C中含有的氯盐只有一种是NaCl,排除NaClO、NaClO3。D中收集 到的气体是氯的一种氧化物,且在D中没有得其它气体,则Na2CO3只是转化成NaHCO3。这样就可以假设有二种可能:NaHCO3和NaCl和Na2CO3、NaHCO3和NaCl。再将产物探究转化为物质的验证可得固体,换句话来说就是验证Cl-、CO
到的气体是氯的一种氧化物,且在D中没有得其它气体,则Na2CO3只是转化成NaHCO3。这样就可以假设有二种可能:NaHCO3和NaCl和Na2CO3、NaHCO3和NaCl。再将产物探究转化为物质的验证可得固体,换句话来说就是验证Cl-、CO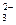
xCl2+xNa2CO3+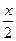 H2O=xNaHCO3+xNaCl+
H2O=xNaHCO3+xNaCl+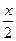 Cl2On↑,Cl2与Na2CO3的物质的量之比为1:1,氧元素守恒n=1,可推出氯的一种氧化物为Cl2O。
Cl2On↑,Cl2与Na2CO3的物质的量之比为1:1,氧元素守恒n=1,可推出氯的一种氧化物为Cl2O。
本题难度:一般