时间:2019-06-25 21:42:32
1、选择题 25℃时,KW=1.0×10-14,100℃,KW=1.0×10-12,这说明( )
A.100℃时水的电离程度较小
B.100℃时水的酸性增强
C.KW与温度无直接关系
D.水的电离是一个吸热过程
参考答案:A、水的电离是吸热过程,温度越高,电离程度越大,100℃时水的电离程度大于常温时的电离程度,故A错误;
B、温度越高,水的离子积数值越大,氢离子和氢氧根离子浓度越大,但始终相等,纯水仍然是中性的,故B错误;
C、水的离子积只受温度的影响,和其他因素无关,故C错误;
D、水的电离是吸热过程,温度越高,电离程度越大,故D正确.
故选D.
本题解析:
本题难度:一般
2、填空题 某化学兴趣小组研究草酸(乙二酸,HOOC-COOH)的性质,他们查找了相关数据。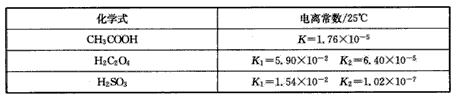
(1)0.1mol/L的CH3COOH、H2C2O4、H2SO3溶液pH最小的是____,最大的是___。
(2)KHSO3的溶液呈酸性,表明HSO3-的电离___水解(填“强于”、“弱手”或“等于”)。
(3)0.1mol/L的H2C2O4溶液与0.1mol/L NaOH溶液等体积混合,溶液的pH=a(溶液的体积等于混合前体积和)。
①则a___7(选填“>”、“<”、“=”或“不确定”);
②c(HC2O4-)+2c(C2O42-)=___(用含a的代数式表示)。
参考答案:(1)H2C2O4 ;CH3COOH
(2)强于
(3)①< ;②0.05+10-a-10-14+a
本题解析:
本题难度:一般
3、选择题 下列各反应的反应式或离子方程式中,能够说明次氯酸是弱电解质的是()
A.次氯酸光照下分解:2HClO 2HCl+O
2HCl+O ↑
↑
B.次氯酸钙溶液中通入适量二氧化碳气体产生白色沉淀:
Ca(ClO) +CO
+CO +H
+H O
O CaCO
CaCO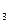 ↓+2HClO
↓+2HClO
C.次氯酸与氢氧化钠中和:
HClO+NaOH NaClO+H
NaClO+H O
O
D.次氯酸与H SO
SO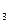 作用:
作用:
HClO+H SO
SO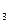
 H
H SO
SO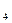 +HCl
+HCl
参考答案:B
本题解析:A中HClO见光分解,显示其不稳定性;B中碳酸是弱酸,Ca(ClO) 中通入二氧化碳产生HClO,说明HClO酸性比碳酸更弱;C中显示其酸性;D中显示其氧化性。
中通入二氧化碳产生HClO,说明HClO酸性比碳酸更弱;C中显示其酸性;D中显示其氧化性。
本题难度:一般
4、选择题 25℃时,几种弱酸的电离常数如下
25℃时,下列说法正确的是
[? ]
A. 等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B. a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)> c(CN-),则a一定大于b
C. NaHS和Na2S混合溶液中,一定存在c(Na+)+c(H+)==c(OH-)+c(HS-)+2c(S2-)
D. 某浓度HCN的水溶液pH=d,则其中c(OH-)=10-d mol/L
参考答案:C
本题解析:
本题难度:一般
5、选择题 常温下,取pH=2的 HA溶液与HB溶液各1 mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示。下列叙述正确的是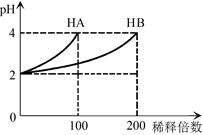
A.HB的电离方程式为HB=H++B-
B.稀释前,c(HB) > c(HA)=0.01 mol·L-1
C.NaA的水溶液中,离子浓度大小为c(Na+)>c(A-)>c(OH-)>c(H+)
D.NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)
参考答案:B
本题解析:pH=2的两种二元酸HA与HB各1mL,分别加水稀释,由图可知,稀释100倍时HA的pH变化大,且pH=4,所以HA为强酸,HB为弱酸,则A、HB的电离方程式为HB H++B-,故A错误;B、由图可知,稀释100倍时HA的pH变化大,且pH=4,所以HA为强酸,HB为弱酸,所以c(HB)>c(HA)=0.01mol/L,故B正确;C、NaA的水溶液显中性,离子浓度大小为c(Na+)=c(A-)>c(OH-)=c(H+),故C错误;D、由于不能确定NaA、NaB的物质的量,因此二者的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)不一定正确,故D错误,故选B。
H++B-,故A错误;B、由图可知,稀释100倍时HA的pH变化大,且pH=4,所以HA为强酸,HB为弱酸,所以c(HB)>c(HA)=0.01mol/L,故B正确;C、NaA的水溶液显中性,离子浓度大小为c(Na+)=c(A-)>c(OH-)=c(H+),故C错误;D、由于不能确定NaA、NaB的物质的量,因此二者的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)不一定正确,故D错误,故选B。
本题难度:一般