时间:2019-06-25 21:22:11
1、选择题 下列判断正确的是
A.酸酐一定是氧化物
B.晶体中一定存在化学键
C.碱性氧化物一定是金属氧化物
D.正四面体分子中键角一定是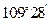
参考答案:C
本题解析:略
本题难度:一般
2、简答题 请回答下列问题:
(1)羰基铁[Fe(CO)5]会使合成甲醇和合成氨等生产过程中的催化剂中毒.Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂.据此可以判断Fe(CO)5晶体类型为______.
(2)科学家通过X射线探明,MgO、CaO的晶体结构与NaCl晶体结构相似(如图所示)
①比较晶体熔点的高低MgO______CaO(填“高于”或“低于”),
②Mg2+的配位原子所构成的立体几何构型为______,③MgCO3晶格能大于CaCO3,为何MgCO3更易分解______.
(3)Ni的堆积与MgO中氧原子堆积相同,Ni可以吸附H2,氢以单个原子形式填入四面体空隙,则Ni最大量吸收H2后,n(Ni):n(H)=______.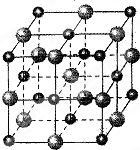
参考答案:(1)由晶体具有常温下为液体,熔沸点低的性质可知,该晶体为分子晶体,故答案为:分子晶体;
(2)①离子晶体中,因镁离子半径小,则晶格能大,所以氧化镁的熔点高于氧化钙的熔点,故答案为:高于;
②以体系为镁离子,六个面的面心为配位原子,则形成空间正八面体结构,故答案为:正八面体;
③碳酸盐分解生成金属氧化物,因镁离子的半径比钙离子的半径小,则氧化镁的晶格能比氧化钙的晶格能大,所以MgCO3更易分解,
故答案为:氧化镁的晶格能比氧化钙的晶格能大;
(3)Ni的堆积与MgO中氧原子堆积相同,O原子占据体心和棱心,晶胞中Ni为1+12×14=4,Ni可以吸附H2,氢以单个原子形式填入四面体空隙,由图可知有个个四面体,则一个晶胞中有8个H,所以Ni最大量吸收H2后,n(Ni):n(H)=4:8=1:2,故答案为:1:2.
本题解析:
本题难度:一般
3、选择题 下列对物质性质的描述中属于分子晶体的是
A.熔点是97.80℃,质软、导电,密度是0.97g/cm3
B.常温常压下是液体,溶于水后能导电
C.熔点极高,硬度极大,液态、固态时,均不能导电
D.固态不能导电,熔点较高,但在熔融状态可以导电
参考答案:B
本题解析:
正确答案:B
A、分子晶体不导电;B、正确;C、不正确,是原子晶体的特点;D、不正确,是离子晶体的特点。
本题难度:一般
4、选择题 有关晶体的结构如下图所示,下列说法中不正确的是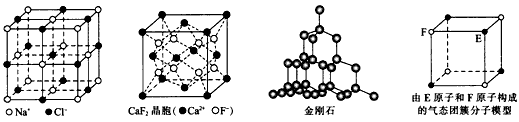
[? ]
A.在NaCl晶体中,距Na+最近的Cl-形成正八面体
B.在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.在金刚石晶体中,碳原子与碳碳键个数的比为1:4
D.该气态团簇分子的分子式为EF或FE
参考答案:CD
本题解析:
本题难度:一般
5、计算题 由烷基镁热分解制得镁的氢化物。实验测定,该氢化物中氢的质量分数为7.6%,氢的密度为0.101 g cm?3,镁和氢的核间距为194.8 pm。已知氢原子的共价半径为37pm,Mg2+ 的离子半径为72 pm。
⑴ 写出该氢化物中氢的存在形式,并简述理由。?
⑵ 将上述氢化物与金属镍在一定条件下用球磨机研磨,可制得化学式为Mg2NiH4的化合物。X-射线衍射分析表明,该化合物的立方晶胞的面心和顶点均被镍原子占据,所有镁原子的配位数都相等。推断镁原子在Mg2NiH4晶胞中的位置(写出推理过程)。?
⑶ 实验测定,上述Mg2NiH4晶体的晶胞参数为646.5 pm,计算该晶体中镁和镍的核间距。已知镁和镍的原子半径分别为159.9 pm和124.6 pm。?
⑷ 若以材料中氢的密度与液态氢密度之比定义储氢材料的储氢能力,计算Mg2NiH4的储氢能力(假定氢可全部放出;液氢的密度为0.0708 g·cm-3)。
参考答案:⑴H-
镁-氢间距离为194.8 pm,Mg2+离子半径为72 pm,则氢的半径为194.8 pm-72 pm =123 pm。此值远大于氢原子的共价半径, 这说明H原子以H? 离子的形式存在。
⑵Mg原子与Ni原子数之比为2 : 1,故每个晶胞中含8个镁原子。所有镁原子的配位数相等,它们只能填入由镍原子形成的四面体空隙。
镁原子的位置用下列坐标参数:
1/4, 1/4, 1/4; 1/4, 1/4, 3/4; 3/4, 3/4, 1/4; 3/4, 3/4, 3/4;
1/4, 3/4, 1/4; 1/4, 3/4, 3/4; 3/4, 1/4, 1/4; 3/4, 1/4, 3/4。
⑶镁镍间的距离为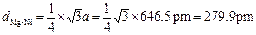 ?
?
不能用原子半径相加计算镁-镍间的距离。
⑷储氢能力=晶体的密度×氢的质量分数÷液氢密度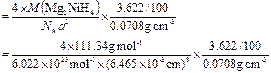 ?
?
= 1.40
=" 1.4"
本题解析:⑴镁-氢间距离为194.8 pm,Mg2+离子半径为72 pm,则氢的半径为194.8 pm-72 pm =123 pm。此值远大于氢原子的共价半径, 这说明H原子以H? 离子的形式存在。
⑵该晶体中,Ni原子按面心立方方式排列,该结构中原子数∶四面体空隙数∶八面体空隙数=1∶2∶1,从Ni和Mg的配位数可知,Mg填入四面体空隙中。
⑶直接利用空间中两点间的距离计算公式,计算(0,0,0)和(1/4,1/4,1/4)两点间的距离。
⑷本题的核心在于检查学生晶体密度的计算公式的掌握及熟练程度,将数据带入公式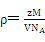 ,求得晶体的密度,乘于氢的质量分数求得储氢密度,最后与液氢的密度相比,求该材料的储氢能力。
,求得晶体的密度,乘于氢的质量分数求得储氢密度,最后与液氢的密度相比,求该材料的储氢能力。
本题难度:一般