时间:2019-06-25 21:15:34
1、选择题 25℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518
kJ/mol。下列热化学方程式书写正确的是
[? ]
A.2H+(aq)+ SO42-(aq)+ Ba2+(aq)+ 2OH-(aq)= BaSO4(s)+2H2O(l);△H= - 114.6 kJ/mol
B.KOH(aq) +1/2H2SO4(aq)=1/2K2SO4(aq)+ H2O(l); △H=-57.3 kJ/mol
C.C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g);△H= -5 518 kJ/mol
D.2C8H18(g)+25O2(g) =16CO2(g)+18H2O(1);△H= -5 518kJ/mol
2、计算题 在25 ℃时,有pH为x的盐酸和pH为y的NAOH溶液,取Vx L该盐酸同该NAOH溶液中和,需Vy L NAOH,求:
(1)若x+y=14时,则Vx/Vy=_______________(填数值)。
(2)若x+y=13时,则Vx/Vy=_______________(填数值)。
(3)若x+y>14时,则Vx/Vy=_______________(填表达式),且VxVy____________(填“>”“=”或“<”)。
3、填空题 某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如下: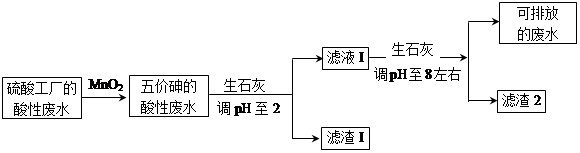
相关数据如下表,请回答以下问题:
表1.几种盐的Ksp
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 9.1×10-6 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 废水浓度 | 29.4g/L | 1.6g·L-1 |
| 排放标准 | pH 6~9 | 0.5mg·L-1 |
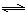 HAsO42-+OH-,该步水解的平衡常数(25℃)为:?(保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为:?(保留两位有效数字)。4、选择题 以酚酞试液为指示剂,对某新制的NaOH溶液进行中和滴定实验,数据记录如下表:该新制NaOH溶液的浓度c计算最合理的是
A.c=0.10×(V1+V2+V3)/3×20.00mol·L-1
B.c=0.10×(V1+V2)/2×20.00 mol·L-1
C.c=0.10×(V1+V3)/2×20.00 mol·L-1
D.c=0.1 0×V1/20.00 mol·L-1
0×V1/20.00 mol·L-1
5、选择题 正确掌握化学用语是学好化学的基础,下列有关化学用语正确的是
A.HCO3-的水解方程式:HCO3-+H2O?H3O++CO32-
B.乙烯的燃烧热是bkJ/mol ,表示燃烧热的热化学方程式为C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)△H=-bkJ/mol
C.以铜为电极电解氯化铜溶液::Cu2++2Cl-== Cu +Cl2↑。
D.在酸性碘化亚铁溶液中通入少量氧气:4I-+ O2 + 4H+ = 2I2 + 2H2O