时间:2019-06-25 21:13:08
1、选择题 25℃时,弱酸的电离平衡常数如下表,下列说法正确的是 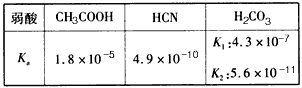
[? ]
A.等物质的量浓度的溶液pH关系:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.amol/L HCN与b mol/LNaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b
C.往冰醋酸中逐滴加水,溶液导电能力先增大,后减小
D.NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)= c(OH-)+c(HCO3-)+c(CO32-)
参考答案:C
本题解析:
本题难度:一般
2、选择题 将0.2mol/L醋酸与0.4mol/L的氢氧化钠溶液等体积混合,溶液中各种离子浓度关系正确的是
[? ]
A. [Na+]=[CH3COO-] > [H+]= [OH-]
B. [Na+]> [OH-]>[CH3COO-]> [H+]
C. [Na+]>[CH3COO-] > [OH-]> [H+]
D. [CH3COO-]> [Na+] > [H+] > [OH-]
参考答案:B
本题解析:
本题难度:一般
3、选择题 物质的量浓度相等的下列溶液pH值由大到小的顺序是
[? ]
A. Na2CO3、NaHCO3、NaCl、NH4Cl
B. Na2CO3、NaHCO3、NH4Cl、NaCl、
C. Na2CO3、NaCl、NH4Cl、NaHCO3
D. Na2CO3、NH4Cl、NaHCO3、NaCl、
参考答案:A
本题解析:
本题难度:一般
4、选择题 下列有关电解质溶液中微粒的物质的量浓度关系正确的是
[? ]
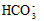 )> c(
)> c(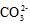 )?> c(H2CO3)
)?> c(H2CO3) 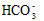 ) + c(H2CO3)
) + c(H2CO3) 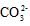 )?>c(
)?>c(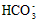 )?>c(OH-)?>c(H+)
)?>c(OH-)?>c(H+)参考答案:D
本题解析:
本题难度:一般
5、选择题 室温下,一元酸HA溶液与一元碱BOH溶液等体积混合,下列有关判断正确的是
[? ]
A.若混合后所得溶液呈中性,则HA肯定是强酸、BOH肯定是强碱
B.若混合前酸、碱pH之和等于14,混合后所得溶液呈碱性,则BOH肯定是弱碱
C.若混合前酸、碱物质的量浓度相同,混合后所得溶液呈酸性,则HA肯定是弱酸
D.若混合后所得溶液呈酸性,则混合溶液中离子浓度一定满足 c(B+)>c(A-)>c(H+)>c(OH-)
参考答案:B
本题解析:
本题难度:一般