时间:2019-05-30 05:42:37
1、填空题 由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式:
。
已知H2O(l) = H2O (g) ΔH = +44 kJ·mol-1,则标准状况下33.6 L H2生成液态水时放出的热量是 kJ 。
2、选择题 1g氢气完全燃烧生成液态水放出142.9kJ的热量,表示该反应的热化学方程式中,正确的是
[? ]
A.2H2(g) + O2(g) = 2H2O(l);△H =+142.9kJ/mol
B.2H2(g) + O2(g) = 2H2O(l);△H =+571.6kJ/mol
C.2H2 + O2 = 2H2O;△H =-571.6kJ/mol
D.H2(g)+1/2O2(g) = H2O(l);△H =-285.8kJ/mol
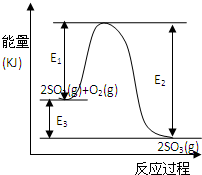
3、填空题 T℃时反应2SO2(g)+O2(g)
2SO3(g)过程中的能量变化如图所示,回答下列问题.
(1)写出该反应的热化学方程式(用E1、E2或E3表示,下同)______
(2)T℃时将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应.2min时反应达到平衡,此时测得反应物O2还剩余0.1mol,则达到平衡时SO2的转化率为______,反应______(填“放出”或“吸收”)______热量.(用E1、E2或E3表示)
(3)下列叙述能证明该反应已达化学平衡状态的是______(填序号)
①SO2的体积分数不再发生变化?②容器内压强不再发生变化?③容器内气体原子总数不再发生变化?④相同时间内消耗2n?molSO2的同时生成n?molO2?⑤相同时间内消耗2n?molSO2的同时生成2n?molSO3
(4)在反应体系中加入催化剂,反应速率增大,E1、E2和E3的变化是:E1______,E2______,E3______(填“增大”“减小”或“不变”).
(5)若以右图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应.写出两电极的电极反应式:______,______
为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为______.
(6)SOCl2是一种无色液体,可与碳共同构成锂电池的正极材料,且其放电时也有SO2气体产生.写出SOCl2在电池中放电时的电极反应式______.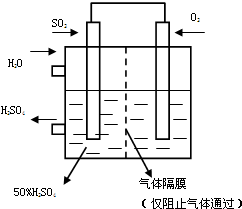
4、选择题 三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热△H?=?-3677kJ/mol(磷元素被氧化为P4O10),下列有关P4S3的说法中不正确的是? 
[? ]
A.分子中每个原子最外层均达到8电子稳定结构
B.P4S3中磷元素为+3价
C.热化学方程式为P4S3(?s)+8O2(g)=P4O10(s?)+3SO2(g);△H?=-3?677kJ/mol
D.分子中存在极性键与非极性键
5、选择题 25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、
2800 kJ/mol,则下列热化学方程式正确的是
[? ]
A.C(s)+1/2O2(g)=CO(g);△H=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g);△H=+571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ/mol
D.1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400 kJ/mol