时间:2019-05-30 05:41:34
1、实验题 (12分) 某同学在实验室欲配制物质的量浓度均为1.0 mol/L的NaOH溶液和稀H2SO4各450mL。提供的试剂是:NaOH固体和98%的浓H2SO4(密度为1.84 g/cm3)及蒸馏水。
(1)配制两种溶液时都需要的玻璃仪器是____________________________________ 。
(2)应用托盘天平称量NaOH ___________g,应用量筒量取浓H2SO4________mL。
(3)配制时,先要检查容量瓶是否漏水,其方法是?
? ?。
?。
(4)浓硫酸溶于水的正确操作方法是_____?______ _____。
_____。
(5)在配制上述溶液实验中,下列操作引起结果偏低的有_________________
A.该学生在量取浓硫酸时,俯视刻度线
B.称量固体NaOH时,将砝码和物品的位置颠倒(没有使用游码)
C.溶解H2SO4操作时没有冷却至室温就立即完成后面的配制操 作。
作。
D.在烧杯中溶解 搅拌时,溅出少量溶液
搅拌时,溅出少量溶液
E.没有用蒸馏水洗烧杯2—3次,并将洗液移入容量瓶中
F.将量筒洗涤2—3次,并全部转移至容量瓶中
G.容量瓶中原来存有少量蒸馏水
H.胶头滴管加水定容时俯视刻度
参考答案:
本题解析:略
本题难度:一般
2、选择题 从下列事实所得出的相应结论正确的为( )
| 实?验?事?实 | 结?论 ① Cl2的水溶液可以导电 Cl2是电解质 ② 将CO2通入到Na2SiO3溶液中产生白色浑浊 酸性:H2CO3>H2SiO3 ③ NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 酸性:HCO3->Al(OH)3 ④ 常温下白磷可自燃而氮气须在放电时才与氧气反应 非金属性:P>N ⑤ 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 该溶液一定有NH4+ |
参考答案:①Cl2的水溶液可以导电,是因为氯气与水反应生成HCl、HClO,HCl电离生成氢离子、氯离子,HClO电离产生氢离子、次氯酸根离子,使溶液导电,HCl、HClO是电解质,氯气既不是电解质也不是非电解质,故①错误;
②CO2通入到Na2SiO3溶液中产生H2SiO3,实际是碳酸与碳酸钠发生反应,反应进行属于复分解反应,符合强酸制备弱酸,故②正确;
③NaHCO3溶液与NaAlO2溶液,反应中碳酸氢钠提供氢离子与偏铝酸根反应生成生成Al(OH)3,符合强酸制备弱酸,故③正确;
④氮气分子中存在N≡N三键,化学性质稳定,但非金属性N>P,故④错误;
⑤气体能使湿润红色石蕊试纸变蓝,该气体为碱性气体,铵盐与碱反应生成氨气,故该溶液一定有NH4+,故⑤正确;
故选B.
本题解析:
本题难度:一般
3、实验题 (16分)黄铁矿的主要成分是FeS2。测定黄铁矿中FeS2含量的两种方法如下图所示: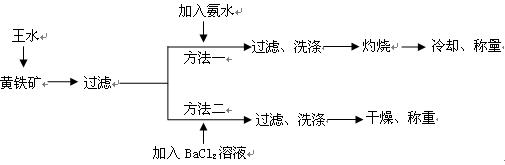
已知:①王水是由1体积的浓硝 酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。
酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。
②黄铁矿和王水反应的方程式为FeS2+5HNO3+3HCl=FeCl3+2H2SO4+5NO↑+2H2O
请回答下列问题:
(1)简述实验室配制王水的操作过程_____________________________________
________________________________________________________________。
(2)方法一中过滤、洗涤、灼烧都用到的仪器是_______________。
(3)方法二中要判断BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是_________(填代号)
A.BaCl2
B.NaOH
C.Na2SO4
D.HCl
(4)实验室利用下列装置和试剂制取少量氯化氢气体试剂:①浓硫酸 ②浓盐酸 ③食盐固体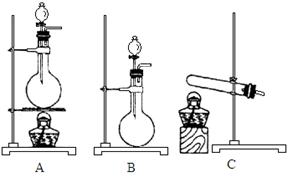
若选用试剂①③,则应选择的装置是___________(填代号,下同);推测发生反应的化学方程式为__________________________________________________;
若选用试剂①②,则宜选择的装置是____________。
(5)方法一中,灼烧时发生反应的化学反应方程式为________________________ ;已知称取黄铁矿样品的质量为1.50g,称得灼烧后固体的质量为0.8g,不考虑操作误差,则该矿石中FeS2的质量分数是________________。
参考答案:(16分,每空2分)
(1)用量筒取3体积的浓盐酸倒入烧杯中,再取1体积的浓硝酸慢慢倒入浓盐酸中,边加边搅拌。
(2)玻璃棒
(3)AC(4A;2NaCl+H2SO4(浓)  Na2SO4+2HCl↑或 NaCl+H2SO4(浓)
Na2SO4+2HCl↑或 NaCl+H2SO4(浓)
(5)2Fe(OH)3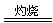 Fe2O3+3H2O? 80%或0.80
Fe2O3+3H2O? 80%或0.80
本题解析:略
本题难度:一般
4、实验题 镍电池由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境 有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下: 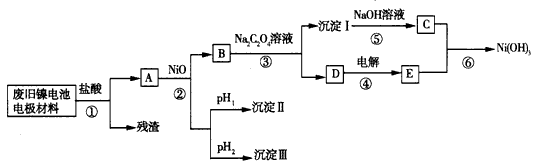
已知:
①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示: 
回答下列问题:
(1)根据上表数据判断步骤②依次析出沉淀Ⅱ:____和沉淀Ⅱ:____(填化 学式),则pH1____pH2(填“>”、“=”或“<”)。
(2)已知溶解度:NiC2O4>NiC2O4·H2O> NiC2O4·2H2O,则步骤③中反应的化学方程式是_______。第③步反应后,过滤沉淀I所需的玻璃仪器有___。
(3)步骤④中阳极反应产生的气体E为一黄绿色气体,写出步骤⑥中反应的离子方程式___
(4) FeCl3和AlCl3的混合溶液中加入NaOH溶液,若Fe(OH)3和Al(OH)3同时存在,则 c(Fe3+)/c(Al3+)=____。
参考答案:(1)Fe(OH)3 ;Al(OH)3 ;<
(2) NiCl2 +Na2C2O4+2H2O=NiC2O4·2H2O↓+2NaCl ;烧杯、漏斗、玻璃棒
(3)2Ni(OH)2 +2OH-+Cl2= 2Ni(OH)3 +2Cl-
(4)2×10-5
本题解析:
本题难度:一般
5、实验题 硫酸亚铁是一种可用于治疗缺铁性贫血的药剂,硫酸亚铁 药片外表面包有一层特制的糖衣,以保护硫酸亚铁不被空气中的氧气氧化成硫酸铁(硫酸铁无治疗贫血的药效)。试设计一个方法,验证某硫酸亚铁药片是否已被氧化(写出主要步骤、现象及有关反应式)。
参考答案:刮去糖衣,把药片研碎,放在烧杯中加少量蒸馏水溶解,滴几滴KSCN溶液,溶液显红色,可知部分或全部亚铁离子已被氧化。 Fe3++SCN-=[Fe(SCN)]2+
本题解析:
本题难度:一般