时间:2019-05-30 05:21:37
1、实验题 用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有 。检验溶液A中含有Fe2+的最佳试剂为_______(填编号,下同)
。检验溶液A中含有Fe2+的最佳试剂为_______(填编号,下同)
①?KMnO4?②(NH4)2S?③?NaOH?④?KSCN
(2)氧化剂可选用_______
① Cl2?②?KMnO4?③?HNO3?④?H2O2
(3)要得到较纯的产品,试剂可选用_______
①?NaOH?②?FeO?③?CuO?④?Cu2(OH)2CO3
(4)从滤液经过结晶得到氯化铜晶体的方法是(按实验先后顺序选填编号)_______
①过滤?②蒸发浓缩?③蒸发至干?④冷却
(5)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需要的仪器是_______ 下列滴定方式中,最合理的是_______?(夹持部分略去)(填字母序号) 
(6)为了测定制得的氯化铜晶体(CuCl2·xH2O)中X的值,某兴趣小组设计了两种实验方案:
方案一:称取mg晶体灼烧至质量不再减轻为止,冷却、称量所得固体无水CuCl2的质量为n1?g
方案二:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为n2g。
试评价上述两种实验方案:其中正确的方案是_______,据此计算得X=_______?(用含m、n1或n2的代数式表示)。
参考答案:(1)①?
(2)①④?
(3)③④?
(4)②④①?
(5)250mL容量瓶;b?
(6)二;
本题解析:
本题难度:一般
2、实验题 超细氧化铝是一种重要的功能陶瓷原料,实验室可以用如下方法来制备这种材料。 
试回答下列问题。
(1)反应①能生成NH4Al(SO4)2的原因是____。
(2)反应②除了生成NH4Al(OH) 2CO3外,还有多种生成物,其中有一种是气体,试写出该反应的化学方程式:___。判断NH4Al(OH)2CO3沉淀已洗涤干净的方法是___。
(3)反应③的化学方程式为___。
(4)已知室温下向NH4Al(SO4)2溶液中逐滴加入NaOH溶液时生成的沉淀的质量与滴入NaOH溶 液的体积关系如图所示。 
①根据图象得V(oa)=___V(ob)=___V(bc)。
②Kb( NH3·H2O)__Kb[Al(OH)3](Kb指弱碱的电离常数),NH4Al(SO4)2溶液中各离子 浓度的大小关系为___。
参考答案:(1)在相同条件下,NH4 Al(SO4)2的溶解度比 ( NH4)2 SO4和Al2(SO4)3的溶解度都小
(2) 2NH4 Al(SO4)2+8NH4HCO3=4( NH4)2 SO4+ 2NH4Al(OH)2CO3+6CO2↑+2H2O; 取最后一次洗涤液,加入BaCl2溶液,无沉淀产生即可说明洗涤干净
(3)2NH4Al(OH)2CO3 Al2O3+3H2O↑+2CO2↑+2NH3↑
Al2O3+3H2O↑+2CO2↑+2NH3↑
(4)①3;3
②> ;c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-)
本题解析:
本题难度:一般
3、实验题 实验室可用如图所示装置制取NaClO3。图中:a为氯气发生装 置.b为NaClO3的制备装置;c为尾气吸收装置。请回答下列问题。 
(1)制取氯气的化学反应方程式(未配平)为:KMnO4+HCl(浓)→ MnCl2+KCl+Cl2↑+H2O,请将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。? □+□
(2)开始实验,打开分液漏斗的活塞,发现浓盐酸流出少量后即难以滴下,经检查分液漏斗活塞没有堵塞,你认为应采取的措施是__________。实验时为了除去氯气中的氯化氢气体,可在a与b之间安装盛有_________(填写下列字母编号)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(3)装置b中发生反应的化学方程式为3Cl2 +6NaOH 5NaCl+NaClO3+3H2O,请推测在加热 NaClO溶液时发生反应的化学方程式:____________
5NaCl+NaClO3+3H2O,请推测在加热 NaClO溶液时发生反应的化学方程式:____________
(4)工业上用石灰乳代替烧碱溶液吸收尾气的原因是__________。工业上用60℃的Na2CO3溶液吸收 Cl2也可制得NaClO3,该反应的离子方程式为_____________ 。
参考答案:(1)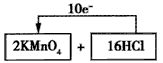
(2)将磨口塞上的凹槽与漏斗口颈上的小孔对准;B
(3)3NaClO2 NaCl+ NaClO3
NaCl+ NaClO3
(4)石灰乳来源丰富、成本低;3Cl2 +3CO32- 5 Cl-+ClO2- +3CO2
5 Cl-+ClO2- +3CO2
本题解析:
本题难度:一般
4、实验题 某同学利用如图所示装置来制取Fe(OH)3胶体。 
[原理分析]实验室制备胶体一般是利用盐类的水解或酸、碱、盐之间的复分解反应。Fe(OH)3胶体就是采用三价铁盐水解的方法来制备的。
[实验设计]在小烧杯中加入25 mL蒸馏水,加热至沸腾,慢慢滴入1~2 mL FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热,即可得Fe(OH)3胶体。实现现象:烧杯中液体呈红褐色。化学方程式:
FeCl3+3H2OFe(OH)3(胶体)+3HCl
(1)实验中必须要用蒸馏水,而不能用自来水。原因是_________________。
(2)实验操作中,必须选用饱和氯化铁溶液而不能用稀氯化铁溶液。原因是______________________。
(3)往沸水中滴加饱和氯化铁溶液后,可稍微加热煮沸,但不宜 长时间加热。这样操作的原因是______________________。
参考答案:(1)自来水中含电解质、杂质较多,易使制备的胶体马上发生聚沉,导致实验失败
(2)氯化铁溶液浓度过稀不利于氢氧化铁胶体的形成
(3)长时间加热会导致氢氧化铁胶体聚沉
本题解析:
本题难度:一般
5、实验题 实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题:已知烧瓶内发生的是制取氯气的反应:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O 
(1)用双线桥法标出烧瓶内发生反应的电子转移方向和数目 ?
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)B处盛有饱和食盐水,其作用是_______________?。
(3)C处盛放的是下列试剂中的_______(填序号);E处盛放的是下列试剂中的______(填序号),发生反应的离子方程式为?_______________。
a、水?b、氢氧化钠溶液?c、浓硫酸?d、饱和食盐水
(4)有同学认为该装置存在缺陷,改进的方法是___________________________。
参考答案:(1)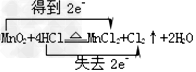 (2)“略”
(2)“略”
(3)c;b;2OH-+Cl2==Cl-+ClO-+H2O?
(4)在D与E?之间增加一支装有碱石灰的干燥管
本题解析:
本题难度:一般