时间:2019-05-30 05:13:21
1、选择题 在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是
A.平衡向正反应方向移动了
B.物质A的转化率增大了
C.物质B的质量分数增加了
D.a>b
参考答案:D
本题解析:当容器体积增加一倍,压强减小,B的浓度瞬间变为原来的50%;当达到新的平衡时,B的浓度是原来的60%,则平衡向右移动,故b>a,物质A的转化率增大,物质B的质量分数增加,选D。
点评:化学平衡是历年高考重中之重,考生一定要系统备考此知识点。
本题难度:一般
2、选择题 体积不变的密闭容器中进行如下反应:X2(g)+ 3Y2(g)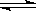 2Z(g),X2、Y2、Z起始浓度分别为0.2mol·L—1、 0.6mol·L—1、0.4mol·L—1,当平衡时,下列数据肯定不正确的是 (? )
2Z(g),X2、Y2、Z起始浓度分别为0.2mol·L—1、 0.6mol·L—1、0.4mol·L—1,当平衡时,下列数据肯定不正确的是 (? )
A.X2为0.4mol·L—1,Y2为1.2mol·L—1
B.Y2为1.0mol·L—1
C.X2为0.3mol·L—1,Z为0.2mol·L—1
D.Z为0.6mol·L—1
参考答案:A
本题解析:若X2为0.4 mol·L—1,则Z完全反应,A错误;若Y2为1.0mol·L—1,则Z消耗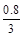 ?mol·L—1,B正确;若X2为0.3mol·L—1,则Z消耗0.2 mol·L—1,,C正确;若Z为0.6mol·L—1,则消耗X20.1 mol·L—1、Y20.3 mol·L—1,D正确。
?mol·L—1,B正确;若X2为0.3mol·L—1,则Z消耗0.2 mol·L—1,,C正确;若Z为0.6mol·L—1,则消耗X20.1 mol·L—1、Y20.3 mol·L—1,D正确。
点评:可逆反应不能完全进行到底。
本题难度:一般
3、选择题 恒温下,容积均为2L的密闭容器M、N中,分别有以下两种起始投料建立的可逆反应
3A(g)+2B(g)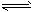 2C(g)+xD(s)的化学平衡状态。相关数据如下:M中初始加入3mol A、2mol B,2min后达到平衡时生成1. 2mol D,测得从反应开始到平衡,C的速率为 0. 3mol/(L·min)。N中初始加入2molC、
2C(g)+xD(s)的化学平衡状态。相关数据如下:M中初始加入3mol A、2mol B,2min后达到平衡时生成1. 2mol D,测得从反应开始到平衡,C的速率为 0. 3mol/(L·min)。N中初始加入2molC、
ymolD,达到平衡时c(A) =0. 6mol/L。下列推断正确的是
[? ]
A.x=2
B.平衡时,M中c(A)<0.6mol/L
C.y>0.8?
D.v<0.8
参考答案:AC
本题解析:
本题难度:一般
4、填空题 (12分)(一)、下列各项分别与哪个影响化学反应速率的因素的关系最为密切?
(1)硫在氧气中比在空气中燃烧剧烈?
(2)MnO2加入双氧水中反应更剧烈?
(3)同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完?
(4)镁粉在冷水中反应仅有微量气泡逸出,但加热时则有大量气泡产生?
(二)、氮化硅是一种新型陶瓷材料,它可由石英晶体与焦炭颗粒在高温的氮气流中,通过如下反应制得:3SiO2 + 6C + 2N2 Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题:
Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题: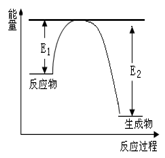
(1)上述反应中的还原剂是?,还原产物是?。
(2)若反应中测得生成4.48 L CO气体(标准状况下),则转移的电子数为?。
(3)该反应是?(填“吸热”或“放热”)反应。
(三)、在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示: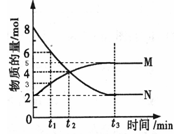
(1)写出该反应的化学方程式为?。
(2)比较t2时刻,正逆反应速率大小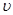 (正)?
(正)?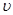 (逆)。(填“>”、“=”、“<”)。.
(逆)。(填“>”、“=”、“<”)。.
(3)若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为?。
(4)t3时刻化学反应达到平衡时反应物的转化率为?。
参考答案:(一) (1)氧气的浓度或密度;(2)催化剂;
(3)固体的表面积或接触面积;(4)温度。
(二) (1)C;? Si3N4。? (2)0.4NA或2.408×1023。 (3)放热。
(三)(1)2N M;(不写可逆符号不得分)(2)>;
M;(不写可逆符号不得分)(2)>;
(3)0.25mol /(L·min)(不写单位不得分);(4)75%或3/4。
本题解析:(二)(1)? 0? 0? -3? +2
3SiO2 + 6C + 2N2 ?Si3N4 + 6CO
?Si3N4 + 6CO
在反应中,C化合价升高,被氧化,做还原剂;N2化合价降低,被还原,得还原产物Si3N4;
(2)由方程式,得:6 CO — 12e-,标准状况下4.48 L CO的物质的量为0.2mol,则转移的电子数为:0.2mol×2×NA="0.4" NA;
(3)分析图像,得:反应物总能量>生成物总能量,所以为放热反应;
(三)(1)分析图像,得:N减少,则N为反应物,M增多,则M为生成物;且N未减少到零,到t3后保持一定值,说明达到了平衡,则N生成M是一个可逆反应:
N M
M
n0? 8? 2
n(平衡) 2? 5?,得:△n(N):△n(M)=6:3=方程式中的化学计量系数之比,
所以:该反应的化学方程式为2N M;
M;
(2)t2时刻,反应还没有达到平衡状态,且反应在正向进行,故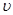 (正)>
(正)>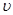 (逆);
(逆);
(3)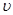 (M)=[(4-2)mol/4L]/2min=0.25mol /(L·min)
(M)=[(4-2)mol/4L]/2min=0.25mol /(L·min)
(4)反应物的转化率=(8-2)/8=75%
本题难度:一般
5、选择题 恒温下,在容积为2L的密闭容器中发生3A(g)+2B(g) ? 2C(g)+xD (s)反应,若起始投料为3molA、2molB,2min达平衡,生成D1.2mol,测得从反应开始到平衡C的速率为0.3mol(L·min)。下列结论不正确的是
? 2C(g)+xD (s)反应,若起始投料为3molA、2molB,2min达平衡,生成D1.2mol,测得从反应开始到平衡C的速率为0.3mol(L·min)。下列结论不正确的是
A.x="2?"
B.平衡时,c(A)=0.6mol/L
C.平衡时,C的体积分数为37.5﹪
D.按n(A) : n(B) : n(C) : n(D)="3" : 2 : 3 : 3继续投料,平衡不动
参考答案:D
本题解析:略
本题难度:简单