时间:2019-05-30 04:35:21
1、填空题 三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.
探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂.
(1)若假设1成立,则实验现象是______.
(2)若滴加?KSCN?试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?______简述你的理由:______.
(3)若固体粉末完全溶解无固体存在,滴加?KSCN?试剂时溶液不变红色,则证明原固体粉末是______,写出发生反应的离子方程式______、______、______.
参考答案:(1)若假设1成立,则溶液中含有Fe3+,遇到KSCN溶液呈红色,故答案为:溶液变为血红色;
(2)如果混合物中含有Cu2O,遇到酸产生Cu,Cu能与Fe3+反应:2Fe3++Cu=2Fe2++Cu2+,则加入KSCN溶液也不变色,故此种说法不正确,
故答案为:不合理;Cu能将Fe3+还原为Fe2+;
(3)固体全部溶解,则一定存在Fe2O3和Cu2O,因为Cu2O溶于硫酸生成Cu和CuSO4,而H2SO4不能溶解Cu,所以混合物中必须有Fe2O3存在,使其生成的Fe3+溶解产生的Cu,反应的有关离子方程式为Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+,
故答案为:Fe2O3和Cu2O的混合物;?Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+.
本题解 91ExAm.org析:
本题难度:一般
2、选择题 部分氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:
下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.V=224
C.样品中CuO的质量为4.0g
D.V=448
参考答案:D
本题解析:推断一:滤渣3.2g一定是全部的铜(硫酸足量可以说明沉淀中无Fe、CuO、Fe2O3,溶液无铜离子可以说明铜都析出了);固体为铜说明溶液中中没有Fe3+(它要和铜反应),所以A错。推断二:最后灼烧得到固体3.2g为Fe2O3,其中含铁元素质量为3.2×112/160=2.24g。铁元素质量=2.24g,而原来固体才5.76g,所以CuO质量不超过5.76-2.24=3.52g,所以C错。推断三:由于最后溶液中溶质为过量H2SO4和FeSO4,而铁元素物质的量=2.24/56=0.04mol,说明参加反应硫酸物质的量=0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,由于合金中氧物质的量=(5.76-3.2-2.24)/16=0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08-0.04=0.04molH+生成氢气,即生成0.02mol氢气,标况体积为448ml,D对。
点评:本题需要讨论三种不同的情况来对选项进行分析。需要学生逻辑清晰,有一定难度。
本题难度:一般
3、填空题 (8分)根据下列流程处理废旧电路板,回收金属M,并制得高效绿色净水剂K2EO4。
据此回答问题:
(1)M的化学式是?。 (2)M?MSO4过程中,氧化剂是?,还原剂是?。
(2)M?MSO4过程中,氧化剂是?,还原剂是?。
(3)写出Z→K2EO4的化学反应方程式:?。
(4)向Y溶液中滴加KI淀粉溶液,变为蓝色,其原因用离子方程式解释为:?。
(5)控制其他条件相同,印刷电路板的金属 M用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下金属M的平均溶解速率(见下表)。
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| V(M)(x10-3mol.L-1.min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
参考答案:(8分)
(1) Cu(1分)?
(2) H2O2 ,Cu (2分)
(3) 10KOH + 3Cl2 + 2Fe(OH)3 ="=" 2K2FeO4 + 6KCl + 8H2O (2分)
(4) 2Fe3+ + 2I— ="=" 2Fe2+ + I2?(2分)
(5) 过氧化氢分解浓度降低造成速率减慢。(1分)
本题解析:略
本题难度:简单
4、填空题 某化学兴趣小组用铁矿石(主要成分为Fe2O3,还有Si O2、A12O3等杂质)提取Fe2O3。操作讨程如下: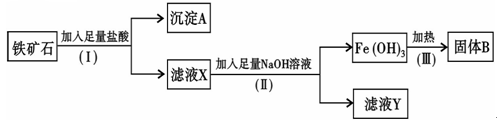
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是?;
(2)沉淀A中主要含有? ?(填化学式),固体B是?(填化学式);
?(填化学式),固体B是?(填化学式);
(3)滤液Y中的阴离子除OH-、Cl-外,还有?(填化学式);
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式?
参考答案:(6分)
(1)过滤?
(2)? SiO2?Fe2O3
(3)A1O2-
(4)Fe3++3OH-? ?Fe(OH)3↓
?Fe(OH)3↓
本题解析:略
本题难度:一般
5、计算题 (6分)、0.6mol·L-1Fe2(SO4)3和1.2mol·L-1CuSO4的混合溶液200mL,加入一定量铁粉充分反应后,测得溶液中Fe2+与Cu2+物质的量之比为2:1,则加入铁粉的物质的量是多少摩尔?
参考答案:0.16mol
本题解析:溶液中铁离子和铜离子的物质的量分别都是0.24mol。由于铜离子的氧化性弱于铁离子的,所以首先是铁离子氧化单质铁,方程式为2Fe3++Fe=3Fe2+;
如果铁离子完全反应,则生成亚铁离子是0.36mol,此时溶液中Fe2+与Cu2+物质的量之比为3︰2,这说明溶液中铁单质也和铜离子反应,方程式为Fe+Cu2+=Fe2++Cu。
设和铜离子反应的单质铁是x,则消耗铜离子是x,生成亚铁离子是x,所以有(x+0.36mol)/(0.24mol-x)=2,解得x=0.04mol,
所以加入的铁粉是0.12mol+0.04mol=0.16mol
本题难度:一般