时间:2019-05-30 04:32:42
1、填空题 已知水在25 ℃和95 ℃时,其电离平衡曲线如右图所示: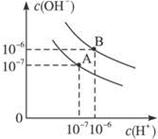
⑴则25 ℃时水的电离平衡曲线应为? ___?(填“A”或“B”),请说明理由? ________________?。
⑵95 ℃时PH=2的NaOH溶液中由水电离的c(H+) ______。
⑶25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为? _________?。
⑷25 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是? _____?。
⑸曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析原因:?。
⑹95 ℃时,某氨水与氯化铵的混合溶液的PH=7,则c(NH4+)______c(Cl-)(填“>”、“<”、或“=”)
参考答案:(14分)⑴①A(2分)②水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小(2分)⑵10-10(2分)⑶10∶1?(2分)⑷a+b=16或pH1+pH2=16(2分)
⑸曲线B对应95 ℃,此时水的离子积为10-12。HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5。(2分)⑹>(2分)
本题解析:(1)电离是吸热,则升高温度,电离程度增加,水中氢离子浓度增加,所以25 ℃时水的电离平衡曲线应为A。
(2)95 ℃时水的离子积常数是10-12,所以pH=2的NaOH溶液中由水电离的c(H+)=10-10mol/L。
(3)若所得混合溶液的pH=7,则 ,解得
,解得 。
。
(4)若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则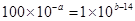 ,所以该强酸的pH1与强碱的pH2之间应满足的关系是a+b=16或pH1+pH2=16。
,所以该强酸的pH1与强碱的pH2之间应满足的关系是a+b=16或pH1+pH2=16。
(5)曲线B对应95 ℃,此时水的离子积为10-12。HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5。
(6)95 ℃时,某氨水与氯化铵的混合溶液的PH=7,则溶液显碱性。所以根据电荷守恒可知c(NH4+)+c(H+)=c(OH-)+c(Cl-),c(NH4+)>c(Cl-)。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固与训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确随着温度的升高,水的离子积常数是增大,在计算pH时需要灵活运用。
本题难度:一般
2、选择题 在某温度下,向容积为2 L的恒容密闭容器中充入0.10 mol AB2和一定量的B2发生反应:2AB2(g)+B2(g) 2AB3(g),当容器中的气体压强不再变化时测得AB2的转化率为80%。已知该温度下上述反应的平衡常数K=2.0×102,则开始时加入B2的物质的量为
2AB3(g),当容器中的气体压强不再变化时测得AB2的转化率为80%。已知该温度下上述反应的平衡常数K=2.0×102,则开始时加入B2的物质的量为
A.0.20 mol
B.0.12 mol
C.0.10 mol
D.0.040 mol
参考答案:A
本题解析:2AB2(g)?+? B2(g) 2AB3(g)
2AB3(g)
起始浓度 0.05mol/L? x? 0
变化浓度 0.05×80%=0.04? 0.02? 0.04
平衡浓度 0.01? x—0.02? 0.04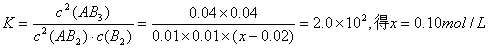 ?
?
即 ;所以正确选项为A。
;所以正确选项为A。
本题难度:一般
3、选择题 反应X(g)+Y(g) 2Z(g);△H<0,达到平衡时,下列说法正确的是:
2Z(g);△H<0,达到平衡时,下列说法正确的是:
A.减小容器体积,平衡向右移动
B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大
D.降低温度,Y的转化率增大
参考答案:D
本题解析:A、此反应是反应前后气体体积不变的反应,减小容器的体积相当于加压,平衡不移动,错误;B、催化剂不能影响化学平衡,错误;C、增大c(X),Y的转化率增大,本身的转化率减小,错误;D、降低温度,平衡向正反应方向移动,Y的转化率增大,正确。
本题难度:一般
4、计算题 (11分)将气体A、B置于容积为5L的密闭容器中,发生如下反应:3A(g) +B(g) 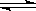 ?2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:?
?2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:?
(1)求用C来表示的该反应的速率?;
(2)求反应前A的物质的量浓度?;
(3)反应10s后,求B物质的转化率?。
(请在答题纸上写出本题详细的解题过程)
参考答案:(1)? 0.016? mol/(L·s)?(2)? 0.6 mol/L? 40%
本题解析:考查可逆反应的有关计算。这种类型的计算一般采用三段式进行计算,即
3A(g) +B(g)  ?2C(g)+2D(g)
?2C(g)+2D(g)
起始量(mol)? a? b? 0? 0
转化量(mol)? 1.2? 0.4? 0.8? 0.8
10s后(mol)? a-1.2? b-0.4? 0.8? 0.8
根据题意可知a-1.2=1.8,b-0.4=0.6
解得a=3.0,b=1.0。所以
(1)用C来表示的该反应的速率为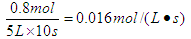
(2)反应前A的物质的量浓度是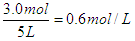
(3)B物质的转化率为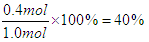
本题难度:一般
5、选择题 已知:4NH3+5O2 4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O) [mol·L-1·min-1]表示,则下列关系正确的是?
4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O) [mol·L-1·min-1]表示,则下列关系正确的是?
[? ]
参考答案:B
本题解析:
本题难度:一般