时间:2019-05-30 04:14:50
1、选择题 将下列物质的水溶液在蒸干、灼烧后,所得固体成分与原溶液溶质不相同的是( )
A.Al2(SO4)3
B.FeCl3
C.Na2CO3
D.KCl
参考答案:B
本题解析:
本题难度:简单
2、选择题 常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
A.某溶液中由水电离出的c(OH-)=1×10-amol?L-1,若a>7时,则该溶液的pH一定为14-a
B.等体积、等物质的量浓度的Na2SO3溶液与NaHSO3溶液混合:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
C.将0.2mol?L-1的某一元酸HA溶液和0.1mol?L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:2c(OH-)+c(A-)=2c(H+)+c(HA)
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液c(Na+)>2c(R2-)+c(HR-)
参考答案:A.常温时,某溶液中由水电离出的c(HO-)=1×10-a?mol/L,若a>7时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液,如为酸溶液,则pH=14-a,如为碱溶液,则pH=a,故A错误;
B.假设各为1mol,则n(Na2SO3)=n(NaHSO3),存在2n(Na+)=3n(Na2SO3)+3n(NaHSO3),根据物料守恒,应有2c(Na+)=3c(SO32-)+3c(HSO3-)+3c(H2SO3),故B错误;
C.根据电荷守恒,应有:c(OH-)+c(A-)=c(H+)+c(Na+),根据物料守恒,应有c(A-)+c(HA)=2c(Na+),二者联式可得:2c(OH-)+c(A-)=2c(H+)+c(HA),故C正确;
D.任何溶液都存在电荷守恒,则应有2c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+),混合液的pH等于7,则c(OH-)=c(H+),应有2c(R2-)+c(HR-)=c(Na+),故D错误;
故选C.
本题解析:
本题难度:一般
3、填空题 在纯碱溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是____________________________________________,其原因是(以离子方程式和简要文字说明):_______________________________________。
参考答案:产生白色沉淀,且红色褪去;在纯碱溶液中,CO32-水解,CO32-+H2O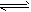 HCO3-+OH-,溶液呈碱性,加入酚酞后溶液呈红色,加入BaCl2后,Ba2++CO32-===BaCO3↓(白色),由于c(CO32-)减小,水解平衡左移,c(OH-)减小,酚酞褪色。
HCO3-+OH-,溶液呈碱性,加入酚酞后溶液呈红色,加入BaCl2后,Ba2++CO32-===BaCO3↓(白色),由于c(CO32-)减小,水解平衡左移,c(OH-)减小,酚酞褪色。
本题解析:
本题难度:一般
4、选择题 下列物质的水溶液显碱性的是
[? ]
A.HClO
B.NaCl
C.FeCl3
D.CH3COONa
参考答案:D
本题解析:
本题难度:简单
5、选择题 勤洗手和经常对环境进行消毒是预防传染病的有效途径。某消毒液为无色液体,用红色石蕊试纸检验,发现试纸先变蓝后褪色。则该消毒液的主要成分可能是
[? ]
A.KMnO4
B.H2O2
C.NaClO
D.NH3·H2O
参考答案:C
本题解析:
本题难度:简单