时间:2019-05-30 04:09:08
1、选择题 惰性电极电解饱和食盐水,当溶液中有1mol NaOH生成时,则下列说法不正确的是
A.阴极析出氢气
B.标准状况下,阴极产生的气体为11.2L
C.阳极的电极反应式:2H2O + 2e- = 2OH-+ H2↑
D.电路中有1mol电子通过
参考答案:C
本题解析:略
本题难度:简单
2、填空题 现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(1)试从下图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:A接 ,B接 。 
(2)铁棒接直流电源的 极;碳棒上发生的电极反应为 。
(3)能说明氯气具有氧化性的实验现象是 。
(4)假定装入的饱和食盐水为50 mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6 mL时,溶液的pH为 。
参考答案:
(1)G、F、I D、E、C
(2)负 2Cl--2e- Cl2↑
Cl2↑
(3)淀粉 KI溶液变成蓝色
KI溶液变成蓝色
(4)12
本题解析:由电解产生的氢气的体积约6 mL和检验氯气的氧化性可知,铁棒作阴极,铁棒上产生的是氢气;碳棒作阳极,从B口导出的是氯气,碳棒上发生的电极反应为2Cl--2e- Cl2↑。当产生的氢气为5.6 mL即为2.5×10-4 mol时,产生的氢氧根离子为2×2.5×10-4 mol=5×10-4 mol,所以氢氧根离子浓度为=0.01 mol·L-1,根据水的离子积可求出氢离子的浓度为1×10-12 mol·L-1,pH为12。
Cl2↑。当产生的氢气为5.6 mL即为2.5×10-4 mol时,产生的氢氧根离子为2×2.5×10-4 mol=5×10-4 mol,所以氢氧根离子浓度为=0.01 mol·L-1,根据水的离子积可求出氢离子的浓度为1×10-12 mol·L-1,pH为12。
考点:原电池、电解池、水的离子积
本题难度:一般
3、选择题 如图装置(I)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池工作的化学方程式为:2K2S2+KI3 K2S4+3KI,装置(Ⅱ)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红。则闭合K 时,下列说法正确的是
K2S4+3KI,装置(Ⅱ)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红。则闭合K 时,下列说法正确的是 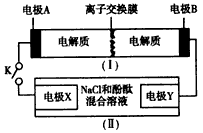
[? ]
A.电极A上发生的反应为:2S22--2e-=S42-
B.K+从右到左通过离子交换膜
C.电极X上发生的反应为:2Cl--2e-=Cl2↑
D.当有0.1 mol K+通过离子交换膜时,Y电极上产生2. 24 L(标准状况)气体
参考答案:A
本题解析:
本题难度:一般
4、填空题 (16分)金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下: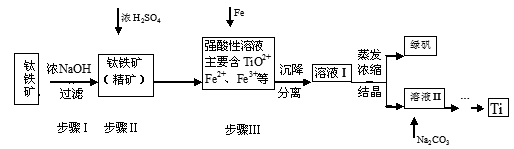
已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式: 、 。
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度(s)与pH关系如图,TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因是 www.91eXam.org; 。
②TiO2+水解的离子方程式为 。向溶液II中加入Na2CO3粉末的作用是 。
当溶液pH接近 时,TiO(OH)2已沉淀完全。
(3)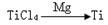 反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
参考答案:(1)Al2O3+2OH-=2AlO2-+H2O (2分);SiO2+2OH-=SiO32-+H2O (2分)
(2)①将Fe3+转化为Fe2+(1分)防止Fe3+与TiO同时生成沉淀(1分) ②TiO2++2H2O=TiO(OH)2+2H+③(2分)调节溶液pH值(1分)促进TiO2+水解(1分)3(2分)
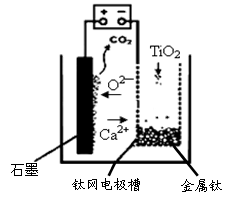
(3)1412(2分)2O2—-4e-=O2↑(1分) C+O2=CO2(1分)或C+2O2—-4e-=CO2↑(2分)
本题解析:钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)当向其中加入NaOH溶液时,Al2O3、SiO2会发生反应,离子方程式是:Al2O3+2OH-=2AlO2-+H2O;SiO2+2OH-=SiO32-+H2O;(2)①得到的精矿中含有FeTiO3,FeO,然后向其中加入浓硫酸,发生反应:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O;4H2SO4(浓)+2FeO=Fe2(SO4)3+SO2↑+4H2O,得到含有H+、Fe2+、Fe3+、TiO2+的溶液,步骤Ⅲ加入铁屑原因会发生反应:2Fe3++Fe=3Fe2+;防止Fe3+与TiO同时生成沉淀;② TiO2+水解的离子方程式为TiO2++2H2O=TiO(OH)2+2H+;向溶液II中加入Na2CO3粉末的作用是消耗溶液中的H+,调节溶液pH值;根据图像可知,当溶液pH接近3时,TiO(OH)2已沉淀完全;(3)TiCl4在隔绝空气时加入Mg发生置换反应产生Ti、MgCl2,同时还有过量的金属Mg,根据混合物中Mg、Ti、MgCl2的熔沸点关系可知当加热的温度略高于1412℃时,Mg、MgCl2变为气体逸出;而Ti则恰好刚刚熔化,因此可以达到分离提纯的目的。(4)由于用惰性电极石墨电极作阳极,所以电解质中的阴离子在阳极放电,该电极的电极式是:2O2—-4e-=O2↑;C+O2=CO2;或写为:C+2O2—-4e-=CO2↑。
考点:考查铁、铝、硅的化合物的性质、盐的水解、反应条件的控制、离子方程式的书写、电解原理在物质制取中的应用的知识。
本题难度:困难
5、选择题 铝及铝合金经过阳极氧化,铝表面能生成几十微米厚的氧化铝膜。某研究性学习小组模拟工业法对铝片表面进行氧化处理。分别以铅片、铝片为电极,以硫酸溶液为电解液,按照如图所示装置连接电解池装置,电解40 min后取出铝片,用水冲洗,放在水蒸气中封闭处理20~30 min,即可得到更加致密的氧化膜。下列有关说法正确的是 ( )。
A.电解时电子从电源负极→导线→铝极,铅极→导线→电源正级
B.在电解过程中,H+向阳极移动,SO 向阴极移动
向阴极移动
C.电解过程阳极周围溶液的pH下降
D.电解的总反应为2Al+6H+===2Al3++3H2↑
参考答案:C
本题解析:A、Al作电解池的阳极,Pb作电解池的阴极,则电子从阳极流出,流到正极,再从负极流回到阴极,错误;B、在电解过程中,阳离子移向阴极,阴离子移向阳极,错误;C、根据题意,Al极是氢氧根离子失去电子生成氧气,氧气与Al反应生成氧化铝,所以阳极区的氢氧根离子浓度减小,氢离子浓度增大,pH下降,正确;D、电池总反应中缺少通电的条件,错误,答案选C。
考点:考查电解原理的应用,电子、离子移动方向的判断
本题难度:一般