时间:2019-05-30 04:09:08
1、选择题 利用右图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生
 产。下列说法中正确的是
产。下列说法中正确的是
A.氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 
C.电镀工业中,X是待镀金属,Y是镀层金属
D.外加电流的阴极保护法中,Y是待保护金属
参考答案:AD
本题解析:铜的电解精炼时,应用粗铜作阳极、纯铜作阴极;电镀时,应以镀层金属作阳极、待镀金属作阴极。
本题难度:一般
2、选择题 有两只串联的电解池(Pt为电极),甲池盛有足量的CuSO4溶液,乙池盛有足量的某硝酸盐的稀溶液.电解时当甲池电极析出6.4gCu时,乙池电极析出21.6g金属,则乙池的溶质可能是( )
A.NaNO3
B.Cu(NO3)2
C.Al(NO3)3
D.AgNO3
参考答案:甲池盛有足量的CuSO4溶液,电解过程中,阴极上的电极反应为:Cu2++2e-=Cu,
当该电极析出6.4gCu即0.1molCu时,转移电子为0.2mol,在转移这些电子的情况下,乙池电极会析出21.6g金属,,设乙池析出金属M,其相对原子量为M,乙池中阴极反应为
? ?Mx++xe-=M,
?1?x? 1
? 0.2mol?2.16M?
则M和x的关系满足:1.08xM=0.1,
将四个选项的金属元素化合价x和相对原子量M代入上式,只有D符合,即x=1,M=108.
故选D.
本题解析:
本题难度:简单
3、选择题 乙醛酸(OHCCOOH)是合成名贵高档香料乙基香兰素的原料之一,可用草酸(HOOCCOOH)电解制备,装置如图所示。下列说法不正确的是
A.电解时石墨电极应与直流电源的正极相连
B.阴极反应式为:HOOCCOOH+2H++2e-=OHCCOOH+H2O
C.电解时石墨电极上有O2放出
D.电解一段时间后,硫酸溶液的pH不变化
参考答案:D
本题解析:由题目提供的信息可知草酸(HOOCCOOH)在电解时被还原得到乙醛酸(OHCCOOH)。还原反应应该是在阴极发生的。所以石墨电极应该与电源的正极相连,作阳极。阳极的电极反应式为:2H2O-4e-=4H++ O2↑,产生氧气。Pb电极为阴极,阴极发生还原反应,反应的方程式为HOOCCOOH+2H++2e- =OHCCOOH+H2O。由上述电极反应式可以看出,H2SO4的物质的量没有变化,水的物质的量也没有变化,但是草酸要不断的消耗,所以溶液的酸性减弱,溶液的pH会增大。因此错误的选项为D.
本题难度:简单
4、填空题 以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎。
Ⅱ.采用如下装置进行电化学浸出实验
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相)  R2Cu(有机相)+2H+(水相)
R2Cu(有机相)+2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是____________。
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是______________________。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式____________________。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是__________;加入有机萃取剂的目的是__________。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是____________。
(5)步骤Ⅳ,若电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是__________。
参考答案:(1)①吸收硫化氢气体,防止环境污染
②Fe2+-e-=Fe3+
(2)2H++2e-=H2↑、Cu2++2e-=Cu、2Cu+O2+2H2SO4=2CuSO4+2H2O
(3)分液漏斗 富集Cu2+、分离Cu2+与其它金属阳离子
(4)增大H+浓度,使平衡2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生
(5)c(H+)>c(SO42-)>c(Cu2+)>c(OH-)
本题解析:(1)根据2Fe3++H2S=2Fe2++S↓+2H+,可判断Fe2(SO4)3的主要作用是氧化H2S气体,防止H2S对环境的污染,当Fe3+被H2S还原为Fe2+后,在阳极上Fe2+-e-=Fe3+,使Fe3+的浓度基本保持不变。
(2)在阴极上,2H++2e-=H2↑,然后Cu2++2e-=Cu,接着在酸性条件下,Cu被O2氧化成CuO,CuO和H2SO4反应生成CuSO4。
(3)有机相和水相不混溶,所以应用分液漏斗分离,由于Cu2+在有机相中,所以加入有机萃取剂可富集Cu2+。
(4)利用化学平衡移动原理解释。
(5)2CuSO4+2H2O 2Cu+2H2SO4+O2↑
2Cu+2H2SO4+O2↑
0.05 mol? 0.05 mol
所以n(H+)=0.1 mol
由于Cu2+的水解,所以n(Cu2+)<0.05 mol,n(H+)>0.1 mol。
所以c(H+)>c(SO42-)>c(Cu2+)>c(OH-)。
本题难度:一般
5、填空题 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和
100 g 10. 00%的K2SO4溶液,电极均为石墨电极。 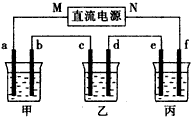
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10. 47%,乙中c电极质量增加。
据此回答问题:
①电源的N端为______极;
②电极b上发生的电极反应为__________________;
③列式计算电极b上生成的气体在标准状况下的体积:_____________。
④电极c的质量变化是_________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液__________;乙溶液__________;丙溶液__________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
________________________
参考答案:(1)①正极;②4OH--4e-=2H2O+O2↑;③水减少的质量: ,生成O2的体积
,生成O2的体积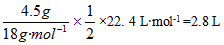 ;④16 g;⑤甲:碱性增大,因为电解后,水量减少,溶液中NaOH浓度增大;乙:酸性增大,因为阳极上OH-生成O2,溶液中H+离子浓度增加;丙:酸碱性大小没有变化,因为K2SO4是强酸强碱盐,浓度增加不影响溶液的酸碱性
;④16 g;⑤甲:碱性增大,因为电解后,水量减少,溶液中NaOH浓度增大;乙:酸性增大,因为阳极上OH-生成O2,溶液中H+离子浓度增加;丙:酸碱性大小没有变化,因为K2SO4是强酸强碱盐,浓度增加不影响溶液的酸碱性
(2)能继续进行,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应
本题解析:
本题难度:一般