时间:2019-05-30 04:05:43
1、实验题 (20分)实验题
Ⅰ以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。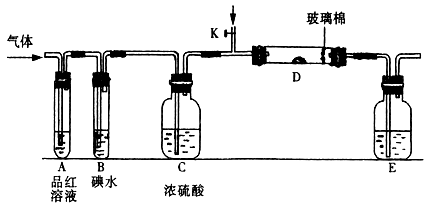
若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同??(填“相同”或“不相同”);若装置D中装的是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为?。
②SO2通入B中,溶液颜色退去,则该反应的离子方程式为?。
(2) 某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母)?,仍然无法观察到沉淀产生。
A.氨水? B.稀盐酸? C.硝酸钾溶液? D.硫化钠溶液
(3)若由元素S和O组成–2价酸根离子X,X中S和O的质量比为2∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式?。?
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如图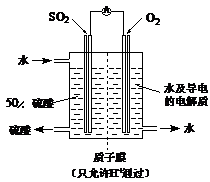
含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入SO2的电极为_________极,其电极反应式为?;电池的总反应式?
Ⅱ实验是化学研究的基础,关于下列各装置图的叙述正确的是?(填序号)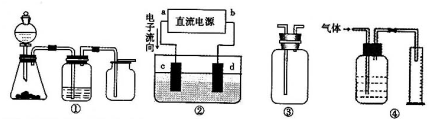
A.装置①可完成多种气体的发生、净化和收集,如铜屑与稀硝酸反应
B.装置②中,a为正极,d为阳极
C.装置③可用于收集H2、NH3、Cl2,、HCl、NO2等
D.装置④能用于测量气体体积
Ⅲ?用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中正确的是?(填序号)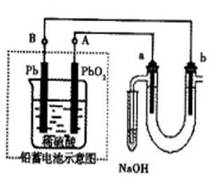
A.铅蓄电池负极的反应式为:Pb—2e-=Pb2+
B.铅蓄电池放电时,B极质量减轻,A极质量增加
C.铅蓄电池充电时,A极应与外电源负极相连
D.电解苦卤水时,a电极首先放电的是Br-
参考答案:Ⅰ (1) ①相同? 2SO2 + O2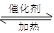 2SO3
2SO3
②SO2 + I2 + 2H2O = 4H++ 2I-+ SO42-?
(2) B
(3) Cl2 + SO32-+H2O = SO42-+ 2Cl-+ 2H+
(4) 负? SO2 – 2e-+ 2H2O = 4H++ SO42-? 2SO2 + O2 + 2H2O = 2H2SO4
Ⅱ C
Ⅲ? D
本题解析:(1)①由于SO2和Cl2都可以使品红溶液褪色,所以A中分别通入SO2和Cl2,观察到的现象是相同的。
若装置D中装的是五氧化二钒(催化剂),通入SO2时,打开K通入适量O2,则发生SO2的催化氧化,反应方程式为2SO2 + O2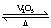 2SO3。
2SO3。
②SO2通入B中,碘水褪色,并不是SO2的漂白作用,而是SO2还原碘为无色的物质,离子方程式为:SO2 + I2 + 2H2O = 4H++ 2I-+ SO42-
(2)SO2通入装有氯化钡溶液,它只与水生成亚硫酸,得到酸性溶液,但与氯化钡是不发生化学反应的(弱酸不能制强酸),无沉淀生成;
A:加入氨水,可得到SO3—,进而生成沉淀:SO3—+Ba2+=BaSO3↓
B:加入稀盐酸,无反应发生,符合题意
C:在酸性情况下,NO3—具有强氧化性,可将SO3—氧化为SO42—,进而得到BaSO4沉淀
D:在酸性情况下,+4价硫与—2价硫发生归中反应,生成浅黄色沉淀硫
(3)由S和O的质量比为2∶3可知,两元素的个数比为1:3,即X为SO32-,此离子被被氧化成SO42-,离子方程式为:Cl2 + SO32-+H2O = SO42-+ 2Cl-+ 2H+
(4)此装置为原电池,原电池的正极发生还原反应,负极发生氧化反应,所以氧气得电子为正极:O2+4e-+4H+=2H2O;总反应为:2SO2 + O2 + 2H2O = 2H2SO4;
由总反应减去负极反应可得负极电极反应为:SO2 – 2e-+ 2H2O = 4H++ SO42-
Ⅱ、A.铜屑与稀硝酸在加热条件下才可反应,不正确
B.a极流出电子,为负极,不正确
C.各气体均不与空气反应,通过改变进出口分别采用向上或向下排气法来收集,正确
D.由于进气导管长,而出气导管短,故不能排出液体,不正确
Ⅲ、A.铅蓄电池负极的反应式为:Pb—2e-+SO42—=PbSO4
B.铅蓄电池放电时,Pb或PbO2均转变为PbSO4,两极质量均增加,不正确
C.铅蓄电池A极为电池正极,充电时应与外电源正极相连
D.a极为阳极,阴离子放电,根据放电顺序可知,首先放电的是Br-,正确
故选D
本题难度:简单
2、实验题 (10分)石油资源紧张曾是制约中国发展轿车事业,尤其是制约轿车进入家庭的重要因素.据2004年5月23日的《扬子晚报》报道,中国宣布将推广“车用乙醇汽油”.乙醇完全燃烧生成CO2和H2O.
(1)写出乙醇完全燃烧的化学方程式______________________________________。
(2)乙醇燃烧时如果氧气不足,可能还有CO生成.用以下装置确证乙醇燃烧产物有CO、CO2、H2O,应将乙醇燃烧产物依次通过(按气流从左到右顺序填装置编号):__________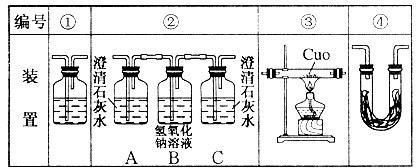 ?
?
(3)实验时可观察到装置②中A瓶的石灰水变浑浊,C瓶的石灰水不变浑浊.A瓶溶液的作用是___________________________;B瓶溶液的作用是________________________;C瓶溶液的作用是______________________________________.
(4)装置③的作用是将CO氧化成CO2.装置①中所盛的是_________________溶液,作用是________________________________.
(5)装置④中所盛的固体药品是________________,它可以确证产生是____________.
参考答案:(10分)(1)CH3CH2OH+3O2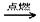 2CO2 +3H2O?(2)④②③①.
2CO2 +3H2O?(2)④②③①.
(3)验证CO2存在;除去混合气体中的CO2;验证混合气体中的CO2是否已被除尽.
(4)将CO氧化成CO2,澄清石灰水[或氢氧化钙、Ca(OH)2]溶液,检验由CO与CuO反应所生成的CO2,从而确证有CO气体.
(5))无水硫酸铜(或CuSO4)H2O(或水).
本题解析:(1)乙醇完全燃烧生成CO2和水,方程式为CH3CH2OH+3O2 2CO2 +3H2O。
2CO2 +3H2O。
(2)验证CO一般用炽热的氧化铜,验证水蒸气一般用无水硫酸铜,验证CO2,一般用澄清的石灰水。由于气体通过溶液一定会带出水蒸气,所以首先验证水蒸气,因此正确的顺序是④②③①。
(3)A瓶溶液的作用是验证CO2存在;瓶溶液的作用是除去混合气体中的CO2;C瓶溶液的作用是验证混合气体中的CO2是否已被除尽。
(4)CO能被氧化铜氧化生成CO2,所以装置①中所盛的是澄清石灰水,作用是检验由CO与CuO反应所生成的CO2,从而确证有CO气体。
(5)装置④中所盛的固体药品是无水硫酸铜,它可以确证产生是水。
本题难度:一般
3、填空题 (12分)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有能看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生现象明显比通入CO2快。
(1)对比分析两组实验,你认为用图一装置实验
时,通入SO2不能出现浑浊的原因可能是:
_________________。
(2)用图二装置实验时,以相同速率通入CO2或
SO2,SO2产生浑浊、澄清的现象比CO2
快的原因是______________________________________。
(3)用图一进行SO2与石灰水反应的实验时,从安全角度
考虑装置应做何改进?
_____________________________________________。
(4)有人提出上述实验现象“石灰水先变浑浊再澄清”可能与澄清石灰水的浓度有关。为了探究CO2通入澄清石灰水中的实验现象,查得下列数据:
Ⅰ 20℃时,Ca(OH)2的溶解度为:0.165g/100g水。
Ⅱ 不同浓度石灰水生成CaCO3的最大量
| 饱和石灰水与水的体积比 | 1:0 | 1:1 | 1:2 | 1:3 | 1:5 | 1:7 |
| 能生成CaCO3的最大量(g/100水) | A | 0.110 | 0.073 | 0.055 | 0.037 | 0.028 |
| 热力学温度/K | 282 | 298 | 308 |
| CaCO3溶解度(g/100水) | 0.130 | 0.094 | 0.076 5 |
| P(CO2)/Pa | 0 | 1.40×104 | 9.95×104 |
| CaCO3溶解度(g/100水) | 0.001 3 | 0.023 3 | 0.108 6 |
参考答案:(1)两者反应时直接生成了酸式盐而看不到沉淀(2分)
(2)SO2溶解度大,且对应的亚硫酸酸性比碳酸强,通入的SO2与石灰水反应快(2分)
(3)增加尾气吸收装置或增加防倒吸装置和尾气吸收装置(2分)(只答“增加防倒吸装置”给1分)
(4)①0.22或0.222、0.223(2分)
②当CO2压力相同时,CaCO3的溶解度随温度的上升而减小;当实验温度相同时,CaCO3的溶解度随CO2压力的增大而增大(其它合理答案也给分);(2分)
③应注意澄清石灰水的浓度和CO2压强及温度(其它合理答案也给分)(2分)
本题解析:略
本题难度:简单
4、实验题 (8分)实验室利用如右图装置进行中和热的测定.请回答下列问题: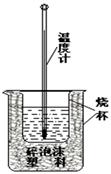
(1)该图中有两处未画出,它们是?、?.
(2)在操作正确的前提下,提高中和热测定准确性的关键是?.
(3)做一次完整的中和热测定实验,温度计需使用_______次.
参考答案:(1)环形玻璃棒?烧杯上方的泡沫塑料盖
(2)提高装置的保温效果?(3)3
本题解析:略
本题难度:简单
5、填空题 某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置。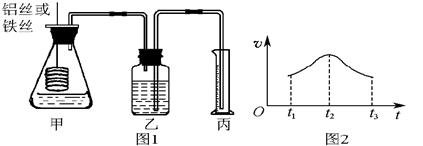
(1)检查图1所示装置气密性的方法是_______________________________________。
(2)若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量_______________________________________________________________。
(3)实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是________________________________。
参考答案:(1)
(2)产生相同体积的气体所需的时间
(3)反应放热,溶液温度升高(占主导作用)
本题解析:略
本题难度:简单