时间:2019-05-30 04:05:43
1、实验题 维生素C对维持人体正常生理功能有重要作用,其分子式是C6H8O6 ,水溶液呈酸性,高温或较长时间受热易损耗。许多新鲜水果、蔬菜、乳制品中都含有丰富的维生素
C,例如:新鲜橙果中的橙汁液中含维生素C浓度在500 mg·L-1左右。
某化学兴趣小组对标有“纯天然鲜橙原汁”的某市售橙汁中维生素C的含量进行了测定,请填写如下相关空白:
实验目的:测定市售××牌软包装纯天然鲜橙原汁饮料中维生素C的含量。
实验原理:C6H8O6 + I2 → C6H6O6 + 2 H+ + 2 I-。
实验用品和试剂:
部分可能用到的仪器如下: ?
? ?
? ?
?
A? B? ?C
?C
试剂:浓度为1.50×10-4mol·L-1的标准碘(水)溶液,指示剂,蒸馏水等。
实验过程:
(1)洗涤仪器,检查是否漏液,用标准液润洗后装好标准液待用。在此步操作中,需用蒸馏水洗涤并需用标准液润洗的仪器有?(从上述A、B、C仪器中选择,填编号)。
(2)打开一袋橙汁包,目测:颜色——橙黄色,澄清度——好。准确量取20.00mL该汁液加入烧杯中溶解,并用100 mL??(填仪器名称)定容配成100 mL稀橙汁。取洁净的 ?(从上述A、B、C仪器中选择,填编号),用上述稀橙汁润洗2~3次,并用该仪器取25.00mL稀橙汁入?中(从上述A、B、C仪器中选择,填编号),再加入约10mL蒸馏水充分摇匀,然后向其中加入2滴指示剂,应加指示剂的名称是?溶液。
(3)用左手操作滴定管,右手摇动锥形瓶,眼睛注视?。滴定至终点时的现象是? ?。
?。
(4)重复上述实验。
(5)数据记录和处理:
| 实验次数 | 稀橙汁体积(mL) | 滴定用标准碘(水)溶液(mL) |
| 1 | 25.00 | 23.10 |
| 2 | 25.00 | 23.00 |
| 3 | 25.00 | 22.90 |
参考答案:(1)A 。
(2)?容量瓶;? A ;? C;?淀粉。
(3)锥形瓶中溶液颜色变化和标准碘溶液滴速。?
锥形瓶中溶液刚由橙(黄)色变为(淡)蓝色且半分钟不变色。
(5)? 121.44。?
(6) 偏低。
本题解析:略
本题难度:一般
2、填空题 某兴趣小组对如何延长硫酸亚铁溶液的保质期展开了研究。
(1)制备硫酸亚铁溶液,最合适的试剂组为___________(填编号);
a.过量铁屑和稀硫酸?b.过量稀硫酸和铁屑?c.过量硫酸铁溶液和铁屑
(2)实验室保存硫酸亚铁溶液的一般方法是_____________________________________;
该兴趣小组取等体积的硫酸亚铁溶液分别加入三个烧杯中,各滴入3 滴KSCN试剂,然后进行如下实验:
| 烧杯编号 | ① | ② | ③ |
| 加入试剂 | 铁粉0.1g | 铁粉0.1g,0.1mol/LH2SO43mL | 0.1mol/LH2SO43mL |
| 红色出现时间(天) | 1天 | 4天左右 | 8天以上 |
参考答案:(1)a(2分)
(2)加入铁钉(或铁屑,合理即可)(以及少量硫酸)(2分,加入稀硫酸不写不扣分)
(3)有气泡产生,铁粉溶解(2分)
(4)溶液酸度越大,硫酸亚铁越不易被氧化(2分)
(5)①4Fe2+ + O2 + 10H2O→ 4Fe(OH)3 + 8H+(2分)
②Fe2+在氧化变质的过程生成H+,所以加入硫酸有利于抑制反应正向进行
本题解析:略
本题难度:一般
3、实验题 某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。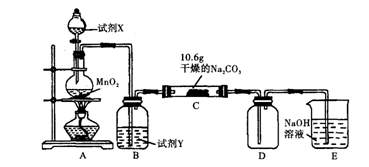
(1)写出装置A中发生反应的化学方程式:?。
(2)写出试剂Y的名称:?。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和?;
假设2:存在三种成分:NaHCO3和?、?。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。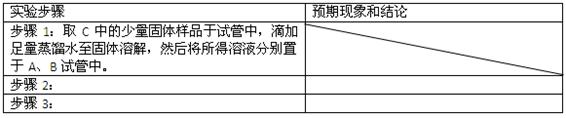
(4)已知C中有0.1mol Cl2参加反应。若假设l成立,可推知C中反应的化学方程式为? ?。
?。
参考答案:(1)4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O(2分)
MnCl2+Cl2↑+2H2O(2分)
(2)饱和食盐水(或饱和氯化钠溶液)(1分)
(3) 假设一:存在NaHCO3和NaCl(2分)
假设二:存在NaHCO3和NaCl、 Na2CO3、(2分)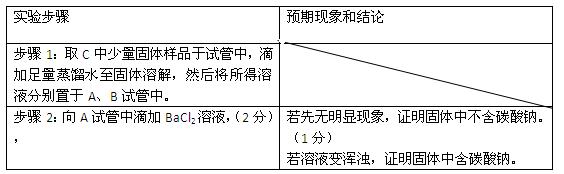
(4)2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O↑(3分)
本题解析:本题主要强化教材实验室制备氯气的知识点。先制备氯气,看到MnO2,可以确定试剂为浓盐酸,试剂Y饱和食盐水(或饱和氯化钠溶液)。根据反应物Cl2、Na2CO3、H2O,从组成的角度来看,可能有NaHCO3、NaCl、NaClO、NaClO3等可能,确定的是C中含有的氯盐只有一种是NaCl,排除NaClO、NaClO3。D中收集 到的气体是氯的一种氧化物,且在D中没有得其它气体,则Na2CO3只是转化成NaHCO3。这样就可以假设有二种可能:NaHCO3和NaCl和Na2CO3、NaHCO3和NaCl。再将产物探究转化为物质的验证可得固体,换句话来说就是验证Cl-、CO
到的气体是氯的一种氧化物,且在D中没有得其它气体,则Na2CO3只是转化成NaHCO3。这样就可以假设有二种可能:NaHCO3和NaCl和Na2CO3、NaHCO3和NaCl。再将产物探究转化为物质的验证可得固体,换句话来说就是验证Cl-、CO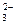
xCl2+xNa2CO3+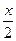 H2O=xNaHCO3+xNaCl+
H2O=xNaHCO3+xNaCl+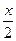 Cl2On↑,Cl2与Na2CO3的物质的量之比为1:1,氧元素守恒n=1,可推出氯的一种氧化物为Cl2O。
Cl2On↑,Cl2与Na2CO3的物质的量之比为1:1,氧元素守恒n=1,可推出氯的一种氧化物为Cl2O。
本题难度:一般
4、选择题 下列实验方案合理的是
A.鉴别集气瓶中的甲烷和乙烯:移去玻璃片,分别点燃,观察火焰的颜色及是否有黑烟
B.检验酒精中的少量水:向酒精中加入足量生石灰
C.制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应
D.除去乙炔中杂质气体:将实验室制得的乙炔气体通入硫酸铜溶液
参考答案:AD
本题解析:B:水的检验一般用五水硫酸铜;
C:乙烷和氯气的混合气放在光照发生取代反应,得到的是各种取代产物,不适宜制备氯乙烷,可用乙烯和氯化氢加成的方法制备氯乙烷。
本题难度:一般
5、实验题 甲酸为不溶于水易溶于乙醇的无色晶体,苯酚常温下能溶于水,易溶于酒精。酸性强弱为:盐酸>苯甲酸>碳酸>苯酚>碳酸氢钠。现有苯甲酸、苯酚一起溶于乙醇所得的混合液,设计一个简单的实验方案,把这三种物质分离为各自的纯净物。按分离的先后顺序的多种可能方案:
方案一:按酸性由弱到强顺序分离
方案二:按酸性由强到弱顺序分离;
……
供选择试剂:①10%氢氧化钠溶液②37%盐酸③Na2CO3溶液④NaHCO3溶液⑤大理石⑥KMnO4溶液⑦生石灰⑧10%H2SO4
(1)?甲同学按实验方案一进行,请填写相关内容。
| 实验步骤 | 写出相应的离子方程式 |
| ①取试样加入足量10%的NaOH溶液,充分振荡后再将反应混合物倒入蒸馏烧瓶中蒸馏得到乙醇、水的混合物和产品A | ①OH-+C6H5-OH→C6H5O-+H2O ②?? |
| ②向步骤①的馏分中加入足量的生石灰,再次蒸馏浓缩,蒸气冷凝后得乙醇。 | CaO+H2O=Ca(OH)2 |
| ③向产品A中通入足量CO2,静置后分液得?和溶液B。 | ? ? |
| ④再向溶液B中加入足量?、静置、过滤后可得苯甲酸。 | ? ? |
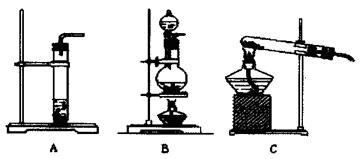
参考答案:
(1)方案一:7分(离子方程式与各空均为1分)
实验步骤
写出相应的离子方程式
?
OH-+C6H5-COOH→C6H5-COO-+H2O
?
?
?苯酚(C6H5-OH)
C6H5O-+CO2+H2O→C6H5OH+HCO3-
?盐酸、
C6H5COO-+H+→C6H5COOH↓
?(2)蒸馏烧瓶、冷凝管、温度计(3分) ?(3)A;将导管连接上A中的玻璃管,再将导气管的末端置于水中,用酒精灯对A中的试管微热,如果看到有气泡冒出,冷却后导气管的末端能回流形成一段水柱,说明A装置气密性良好。(4分)
?(3)A;将导管连接上A中的玻璃管,再将导气管的末端置于水中,用酒精灯对A中的试管微热,如果看到有气泡冒出,冷却后导气管的末端能回流形成一段水柱,说明A装置气密性良好。(4分)
本题解析:略
本题难度:一般