时间:2019-05-30 04:05:43
1、实验题 某同学进行实验研究时,欲配制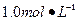 Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。
Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。
(1)烧杯中未溶物仅为BaCO3,理由是?
(2)假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成,设计实验方案,进行成分检验。在答题卡上写出实验步骤、预期现象和结论。(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
(3)将试剂初步提纯后,准确测定其中Ba(OH)2·8H2O的含量。实验如下:
①配制250ml 约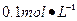 Ba(OH)2·8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,?,将溶液转入?,洗涤,定容,摇匀。
Ba(OH)2·8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,?,将溶液转入?,洗涤,定容,摇匀。
②滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将 ??(填“0.020”、“0.05”、“0.1980”或“1.5”)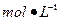 盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。
盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。
③ 计算Ba(OH)2·8H2O的质量分数=?(只列出算式,不做运算)
(4)室温下,?(填“能”或“不能”) 配制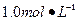 Ba(OH)2溶液。
Ba(OH)2溶液。
2、填空题 (12分)某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如下图所示的实验装置。请你根据他们的思路,回答有关的问题。
(一)实验仪器:大试管、玻璃导管、橡皮塞、烧杯、棉花、注射器。
(二)实验药品:铜丝、稀硝酸、碳酸钙颗粒、烧碱溶液。
(三)实验原理:
铜与稀硝酸反应的离子反应方程式?①?。
(四)实验步骤:
1、按右图所示连接好装置,检验装置的?②?;
2、向试管中加入一定量的固体药品(填化学式)?③?,然后向试管中倒入过量的稀硝酸,并迅速塞紧带铜丝和导管的橡皮塞;
3、让试管中的反应进行一段时间后,用蘸有NaOH溶液的棉花团封住导管口;
4、将铜丝向下移动插入试管液体中,使之与稀硝酸反应;
5、把注射器的针孔插入试管口的橡皮塞中,缓慢向试管内推入空气。
(五)实验讨论:
1、实验步骤②的目的是(写出反应的离子方程式,结合文字说明)
?④?;
2、实验步骤⑤的目的是(写出反应的化学方程式,结合文字说明)
?⑤?。
(六)实验评价:
该装置的优点是(任写一个即可)?⑥?;
有同学提出:增加右图所示装置,在步骤②完成后,当有明显现象再撤去该装置,并继续步骤③的“用蘸有NaOH溶液的棉花团封住导管口”。请评价他的做法?⑦?。
3、实验题 (10分)实验小组测定某肥料中的总氮含量(以氮的质量分数表示) ,实验装置如下图(图中加热及夹持仪器略去):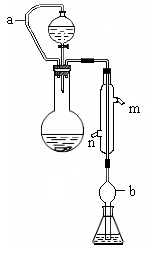
称取1.200 g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00 mL浓度为0.5000 mol/L-1硫酸溶液充分吸收,再用浓度为0.1000 mol/L-1氢氧化钠溶液滴定未反应的硫酸。重复上述实验三次。实验数据如下:
| 实验次数 | 氢氧化钠溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | |
| 1 | 0.00 | 5. 01 |
| 2 | 6.00 | 10.99 |
| 3 | 12.00 | 17.60 |
4、选择题 据报道1991-1996年人类发现和创制的化合物已有1000多万种,这正好相当于到1990年以前人类在1000多年来已知物质的总量;此外,关于物质的信息量也剧增。请你推断:新发现和新创制的物质主要是
[? ]
A.放射性同位素
B.无机物
C.有机化合物
D.烃类物质
5、选择题 通过观察法不能确定下列物质是否变质的是( )
A.FeSO4
B.Na2O2
C.C6H5OH
D.Na2SO3