时间:2019-05-30 03:36:15
1、选择题 如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是
[? ]
A.电源B极是正极
B.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2
C.欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置丁中看到的现象是X极附近红褐色变深
参考答案:B
本题解析:
本题难度:一般
2、选择题 可以将反应Zn+Br2 = ZnBr2设计成蓄电池,下列4个电极反应
①Br2 + 2e-= 2Br- ②2Br- - 2e-= Br2 ③Zn
参考答案:
本题解析:
本题难度:一般
3、选择题 用阳极X和阴极Y电解N的水溶液,通电一段时间后仍为N溶液,再加入M,电解液N能恢复到电解前状态的是:
| 组号 | X | Y | N | M A C Fe KCl 盐酸 B Pt Cu CuSO4 Cu(OH)2 C C Cu H2SO4 H2O D Ag C AgNO3 AgNO3固体 |
参考答案:A、以Fe和C为电极,电解氯化钾,阳极氯离子放电,阴极氢离子放电,通电一段时间后为氢氧化钾溶液,故A错误;
B、以Pt和Cu为电极,电解硫酸铜,阳极氢氧根离子放电,阴极铜离子放电,通电一段时间后为硫酸溶液,故B错误;
C、以C和Cu为电极,电解硫酸,阳极氢氧根离子放电,阴极氢离子放电,相当于电解水,通电一段时间后仍为硫酸溶液,可以加水让溶液复原,故C正确;
D、以Ag和C为电极,电解AgNO3,阳极银离子放电,阴极银离子放电,相当于电镀,通电一段时间后仍为AgNO3溶液,且浓度不变,不需要加AgNO3固体恢复原样,故D错误.
故选C.
本题解析:
本题难度:简单
4、选择题 下列叙述正确的是
[? ]
A.电解饱和食盐水制烧碱时,Fe作阳极,石墨作阴极
B.电解氯化铜时,阳极上产生的气体质量和阴极上析出的铜的质量相等
C.钢铁在空气中发生电化腐蚀时,铁作负极
D.原电池工作时,阳离子移向电池的负极
参考答案:C
本题解析:
本题难度:一般
5、填空题 在下图中,甲烧杯中盛有100 mL0.50 mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.25 mol·L-1 CuCl2溶液,A、B、C、D 均为质量相同的石墨电极,如果电解一段时间后,发现A极比C 极重1.9g,则
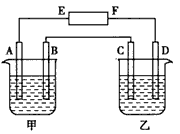
参考答案:(1)负 ;正
(2)4Ag+ +4e- ==4Ag ;0.025
(3)4OH--4e-==2H2O+O2 ;140
(4)Cu2+ +2e-==Cu ;0.0125
(5)2Cl- -2e-==Cl2↑ ;280
(6)B ;HNO3
本题解析:
本题难度:一般