时间:2019-05-30 03:36:15
1、选择题 pH=a某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH<a,则该电解质可能是
A.Ba(OH)2
B.HCl
C.Na2SO4
D.AgNO3
2、选择题 在25℃时,用铂电极电解一定量的Na2SO4饱和溶液,一段时间后,阳极析出amol气体,同时溶液中析出bg Na2SO4·10H2O,如果在这一过程中温度不变,则此时Na2SO4溶液中溶质的质量分数为(?)
A.(71/161)×100℅
B.〔71b/161(18a+b)〕×100℅
C.〔b/(18a+b)〕×100℅
D.〔71b/161(36a+b)〕×100℅
3、选择题 下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b
4、选择题 用惰性电极电解一定量的硫酸铜溶液,通电一段时间后,向电解后的溶液中加入0.1mol
Cu(OH)2固体,恰好能使硫酸铜溶液恢复原来的浓度和质量,则在电解过程中转移的电子的
物质的量为 (?)
A.0.2mol
B. 0.4mol
C.0.5mol
D.0.6mol
5、选择题 下列有关离子方程式与所述事实相符且正确的是
A.用惰性电极电解CuCl2溶液2Cu2+2H2O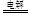 4H++O2↑+2Cu
4H++O2↑+2Cu
B.Ba(OH)2溶液中滴加NaHSO4溶液至中性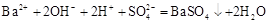
C.漂白粉溶液在空气中失效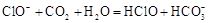
D.用氯化铁溶液和沸水反应制取氢氧化铁胶体