时间:2019-05-30 03:34:58
1、选择题 室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中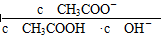 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
2、填空题 已知25℃时弱电解质电离平衡常数:
Ka(CH3COOH)?l.8 xl0-5,Ka(HSCN)?0.13
(1)将20mL,0.10mol/L CH3COOH溶液和20mL,0.10mol/L的HSCN溶液分别与0.10mol/L的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图。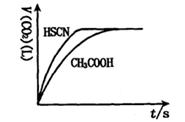
反应开始时,两种溶液产生CO2的速率明显不同的原因是?;
反应结束后所得溶液中c(SCN-)____?c(CH3COO-)(填“>”,“=”或“<”)。
(2)2.0×l0-3mol/L的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-),c(HF)与溶液pH的关系如下图。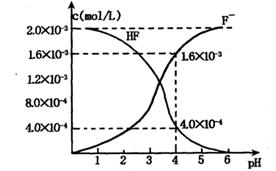
则25℃时,HF电离平衡常数为:(列式求值)Ka(HF)=?
(3)难溶物质CaF2溶度积常数为:Ksp= 1.5×10-10,将4.0×10-3mol/L HF溶液与4.0×l0-4 mol/L的CaCl2溶液等体积混合,调节溶液pH =4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成?____?(填“有”或“没有”),筒述理由:?。
3、填空题 (Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验 编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
 H++B2-
H++B2-4、选择题 已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH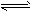 CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
[? ]
A.加少量烧碱
B.降低温度
C.加少量冰醋酸
D.加水
5、简答题 以下说法中正确的是( )
A.pH=2的酸溶液稀释100倍后溶液的pH=4
B.c(NH4+)相等的(NH4)2SO4溶液与(NH4)2S溶液中:c[(NH4)2SO4]<c[(NH4)2S]
C.25℃时纯水的pH低于100℃时纯水的pH
D.pH=3的硫酸物质的量浓度是pH=3的醋酸物质的量浓度的0.5倍