时间:2019-05-30 03:34:58
1、选择题 在25℃时,用蒸馏水稀释1 mol/L的醋酸溶液至0.01 mol/L,随溶液的稀释,下列说法正确的是
A.溶液中所有离子浓度均减小
B.pH的变化值等于2
C.溶液中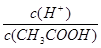 保持增大趋势
保持增大趋势
D.分别与足量的Mg粉反应,0.01 mol/L的醋酸溶液产生的氢气较少
参考答案:C
本题解析:A.醋酸溶液中存在电离平衡,稀释促进电离,氢离子浓度降低。水的离子积常数不变,氢氧根离子浓度增大,A错误;B.由于在稀释过程中氢离子的物质的量增加,则稀释100倍后,pH的变化值小于2,B错误;C.稀释过程中氢离子的物质的量增加,醋酸的物质的量减小,则溶液中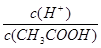 保持增大趋势,C正确;D.稀释过程中醋酸的物质的量不变,则分别与足量的Mg粉反应产生的氢气一样多,D错误,答案选C。
保持增大趋势,C正确;D.稀释过程中醋酸的物质的量不变,则分别与足量的Mg粉反应产生的氢气一样多,D错误,答案选C。
考点:考查醋酸电离平衡的有关判断
本题难度:一般
2、选择题 醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验探究”的探究活动。该同学设计了如下方案,其中错误的是 ( )
A.先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质
B.先配制一定量0.01 mol/L和0.10 mol/L的CH3COOH,分别用pH计测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质
C.取等体积、等pH的CH3COOH溶液和盐酸分别与足量锌反应,若测得反应过程中醋酸产生H2较慢且最终产生H2较多,则醋酸为弱酸
D.配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质
参考答案:C
本题解析:
答案:C
C.不正确,取等体积、等pH的CH3COOH溶液和盐酸分别与足量锌反应,因醋酸难电离,醋酸浓度较大,若测得反应过程中产生H2较快且最终产生H2较多,则醋酸为弱酸
本题难度:简单
3、填空题 为了证明醋酸是弱电解质,甲、乙、丙、丁、戊、己、庚七人分别选用下列试剂进行实验:
0.10 mol/L醋酸溶液、0.10 mol/L醋酸钠溶液、pH=3的盐酸、pH=3的醋酸、醋酸钠晶体、氯化钠晶体、甲基橙、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.10 mol/L的醋酸溶液pH=4,则认定醋酸是弱电解质,你认为这一方法正确吗??。(填“正确”或“不正确”)
(2)乙取出10 mL 0.10 mol/L的醋酸溶液,用pH试纸测出其pH=a,然后用蒸馏水稀释到1 000 mL,再用pH试纸测定其pH=b,要确定醋酸是弱电解质,则a、b应该满足的关系是?(用等式或不等式表示)。
(3)丙取出10 mL 0.10 mol/L醋酸溶液,滴入甲基橙试液,显红色,再加入醋酸钠晶体,颜色变橙色,你认为这一方法能否证明醋酸是弱电解质??。(填“能”或“不能”)
(4)丁用pH试纸来测定0.10 mol/L醋酸钠溶液的pH,发现0.10 mol/L醋酸钠溶液的pH为9,则认定醋酸是弱电解质,你认为这一方法正确吗??。(填“正确”或“不正确”)
参考答案:(1)正确? (2)b<a+2? (3)能? (4)正确
本题解析:(1)正确,若醋酸为强酸,则其溶液的pH=1,现醋酸溶液pH=4,说明醋酸没有完全电离,存在电离平衡。
(2)假设如果它是强酸,稀释100倍,溶液的pH=a+2,因为它是弱酸,故pH<a+2。
(3)能,加入醋酸钠晶体,颜色变橙色,说明溶液的酸性变弱,CH3COO-抑制了醋酸的电离,故醋酸为弱电解质。
(4)正确,由题意知,醋酸钠溶液呈碱性,说明醋酸钠中的醋酸根离子发生了水解,故醋酸为弱酸
本题难度:一般
4、选择题 有a、b、c、d四种一元酸的溶液,实验表明:
①物质的量浓度相同的a、c溶液中,分别滴入甲基橙试液后,a溶液呈黄色而c溶液呈橙色;②物质的量浓度相同的b、c的钠盐溶液相比较,b的钠盐溶液pH小于c的钠盐溶液pH;③a酸跟d的盐反应生成a的盐和d酸.由此可以确定四种酸的酸性由强到弱的顺序正确的是
A.b?a?c?d
B.d?a?c?b
C. b?c?a?d
D.c?d?a?b
参考答案:C
本题解析:略
本题难度:一般
5、填空题 (1)常温下,有0.1mol/L的盐酸和0.1mol/L的醋酸溶液,回答下列问题:
①比较两溶液的pH,盐酸 (填“<”、“=”或“>”)醋酸,写出醋酸电离的方程式 。
②两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠,实验室现有部分醋酸钠固体,取少量溶于水,溶液呈 性(填“酸” 、“中” 或 “碱”),其原因是(用离子方程式表示) 。
(2)向盛有1 mL 0.1 mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
参考答案:(1)① < (1分) CH3COOH CH3COO-+ H+ (1分)
CH3COO-+ H+ (1分)
②碱(1分) CH3COO-+H2O CH3COOH + OH-(1分)
CH3COOH + OH-(1分)
(2)白色沉淀转变为红褐色沉淀;(1分)2Fe3++3Mg(OH)2=2Fe(OH)3+3Mg2+(1分)
本题解析:(1):①氯化氢是强电解质,在水中完全电离,所以盐酸溶液中氢离子浓度等于盐酸浓度,醋酸是弱电解质,在水中只有部分电离,醋酸溶液中氢离子浓度小于醋酸浓度,所以相同浓度的盐酸和醋酸溶液,醋酸溶液中氢离子浓度小于盐酸溶液中氢离子浓度,导致盐酸溶液的pH值小于醋酸溶液的pH值;醋酸的电离方程式为:CH3COOH CH3COO-+H+;
CH3COO-+H+;
②醋酸钠是强碱弱酸盐,因醋酸根的水解CH3COO-+H2O CH3COOH+OH-,导致其溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性;
CH3COOH+OH-,导致其溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性;
(2)氯化镁溶液会和氢氧化钠反应生成氢氧化镁沉淀,加入氯化铁,由于Fe(OH)3比Mg(OH)2更难溶,沉淀会向着更难溶的氢氧化铁转化,故白色沉淀转化为红褐色的沉淀,即:3Mg(OH)2+2Fe3+===3Mg2++2Fe(OH)3.
考点:对吸热和放热反应的正确性判断。
本题难度:一般