时间:2019-05-30 03:30:38
1、选择题 用水稀释0.1mol·L-1 氨水时,溶液中随着水量的增加而减小的是( )
A.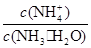
B.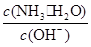
C.c(H+)×c(OH-)
D.OH-的物质的量
参考答案:B
本题解析:在氨水中存在电离平衡:NH3·H2O NH4++OH-。当加水稀释时,平衡正向移动,c(NH4+)减小的倍数小于c(NH3·H2O)减小的倍数,所以
NH4++OH-。当加水稀释时,平衡正向移动,c(NH4+)减小的倍数小于c(NH3·H2O)减小的倍数,所以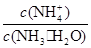 增大,选项A错误;当加水稀释时,平衡正向移动,c(OH-)减小的倍数小于c(NH3·H2O)减小的倍数,所以
增大,选项A错误;当加水稀释时,平衡正向移动,c(OH-)减小的倍数小于c(NH3·H2O)减小的倍数,所以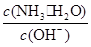 减小,选项A正确;加水稀释,一水合氨电离平衡正向移动,但是由于温度不变,所以溶液中c(H+)×c(OH-)不变,选项C错误;由于加水促进一水合氨的电离作用,所以OH-的物质的量增大,选项D错误。
减小,选项A正确;加水稀释,一水合氨电离平衡正向移动,但是由于温度不变,所以溶液中c(H+)×c(OH-)不变,选项C错误;由于加水促进一水合氨的电离作用,所以OH-的物质的量增大,选项D错误。
考点:考查弱电解质的稀释过程中微粒浓度的变化关系的知识。
本题难度:一般
2、选择题 在100 mL 0.1 mol·L-1的CH3COOH溶液中欲使CH3COOH 的电离度增大且c(H+)降低,可采用的方法是?
[? ]
参考答案:B
本题解析:
本题难度:一般
3、选择题 pH相同的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌粒全部溶解且放出气体一样多,为此下列说法正确的是
A.反应开始时的速率:甲<乙
B.反应开始时,酸的物质的量浓度:甲<乙
C.反应所需时间:甲<乙
D.反应后溶液的pH:甲<乙
参考答案:B
本题解析:起始时酸的pH相同,氢离子浓度相同,反应速率相同,醋酸浓度大于盐酸浓度,A错误、B正确;反应过程中醋酸电离补充氢离子,醋酸反应速率快,反应所需要的时间盐酸多,C错误;最后锌全部溶解且放出氢气一样多说明参加反应的锌一样多,而盐酸的物质的量小于醋酸,所以与盐酸反应后溶液的pH大,D错误。
点评:金属与酸反应时,产生氢气的速率决定于氢离子浓度,产生氢气的量决定于酸或金属的物质的量。
本题难度:一般
4、选择题 下列表达不正确的是
A.NaHS在水中的电离方程式为:NaHS=Na++HS- 和HS-  H++S2-
H++S2-
B.同物质的量浓度的氨水和盐酸反应至中性时所用体积:V(NH3·H2O)<V(HCl)
C.Na2SO3溶液中:c(H+)+ c(HSO3-)+ 2c(H2SO3)= c(OH-)
D.同浓度的下列溶液中,c(CH3COO-)的大小:CH3COONa>CH3COONH4>CH3COOH
参考答案:B
本题解析:HS-是弱酸阴离子,在水溶液中部分电离,A正确;同物质的量浓度的氨水和盐酸反应至中性时,氨水的体积应稍大于盐酸的体积,B错;根据质子守恒,水电离出的H=和OH-应相等,所以c(H+)+ c(HSO3-)+ 2c(H2SO3)= c(OH-),C正确;CH3COO-能发生水解,NH4+发生水解,对CH3COO-的水解起促进作用,醋酸是弱酸,少量电离,D正确;
本题难度:一般
5、选择题 在水中加入少量硫酸氢钠后,溶液的(? )
A.pH增大
B.C(OH-)不变
C.酸性增强
D.C(H+)与C(OH-)的乘积增大
参考答案:C
本题解析:NaHSO4可电离出H+。
本题难度:一般